eLife |俞立/刘志华团队合作开发eMigrasome高效装载抗原并激发广谱免疫应答
当前,全球面临着新发传染病和癌症疫苗开发的巨大挑战。传统疫苗,尤其是mRNA疫苗虽然在新冠疫情防控中取得了突破,但因对冷链运输的高度依赖,极大限制了其在资源有限地区的广泛应用。此外,部分疫苗平台在抗原递送、免疫反应类型及热稳定性等方面仍存在不足。迁移体(migrasome)是近年来发现的一类细胞器,由细胞迁移过程中产生具有高度稳定性和富集免疫调节分子的特点,理论上有望成为新型疫苗递送载体。但自然迁移体的产量极低,制约了其应用开发。
2025年11月13日,来自清华大学刘志华和俞立团队合作在eLife上发表了题为Engineered migrasomes provide a robust and thermally stable vaccination platform的研究文章。为克服上述瓶颈,研究者基于对迁移体生物物理特性的理解,通过低渗冲击与细胞骨架扰动协同诱导成功开发出高效可控、类迁移体结构的工程迁移体(eMigrasome)。研究发现eMigrasome不仅在结构和功能上高度模拟天然迁移体,且能够稳定包载抗原、激发强效体液免疫反应,并具有显著的室温热稳定性。该工程迁移体平台为疫苗递送提供了创新且实用的解决方案,尤其在冷链条件受限的场景下显示出独特优势。

为了回答如何高效制备结构与功能均模拟天然迁移体的eMigrasome,研究者系统研究了低渗冲击诱导与细胞骨架扰动对迁移体形成的影响。通过在表达关键四跨膜蛋白Tspan4的细胞中施加分步低渗刺激并联合微丝破坏剂latrunculin A处理,细胞发生体积收缩促使细胞膜在多点粘附下形成大量“回缩纤维”并在其上高效生成迁移体样囊泡。进一步通过离心和筛选等纯化流程,获得了尺寸一致、结构完整的eMigrasome。冷冻电镜和蛋白免疫印迹证实,eMigrasome高度富集Tspan4等迁移体标志蛋白并与天然迁移体在生物物理性质和分子组成上高度一致。机制实验显示,eMigrasome的形成依赖于四跨膜蛋白、胆固醇及鞘磷脂等核心因子,且多种哺乳动物细胞均可作为生产平台实现大规模高效制备。这一创新方案克服了天然迁移体产量低、异质性高的难题,为后续功能性研究和疫苗开发奠定了基础。
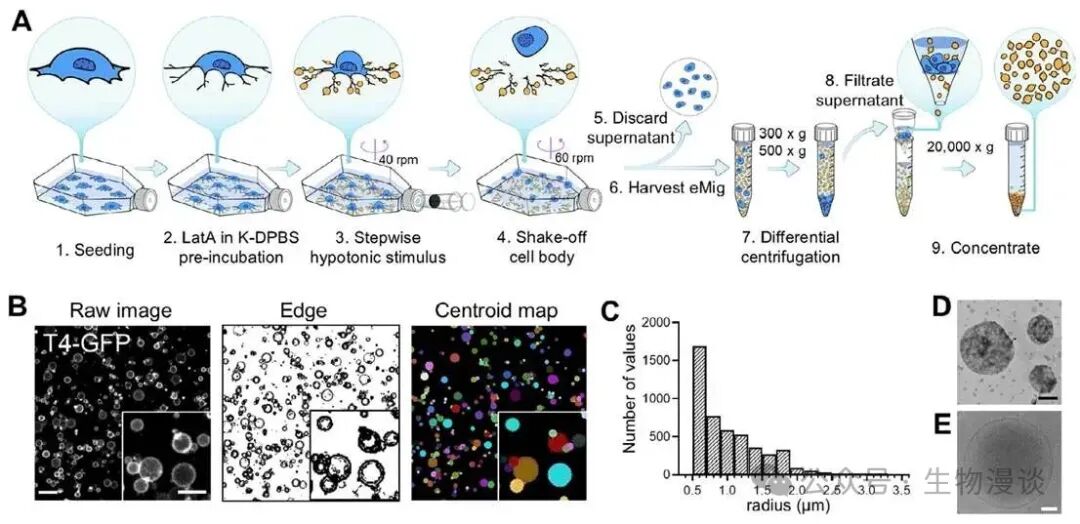
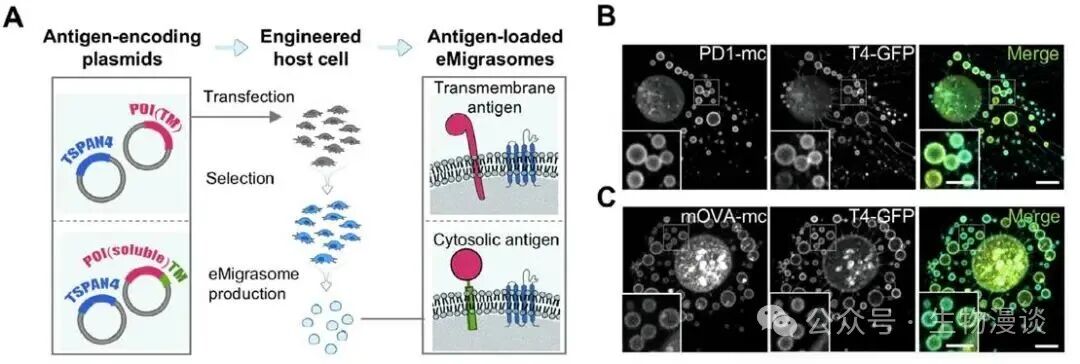
在高效制备eMigrasome的基础上,研究进一步系统评价了其结构稳定性及抗原装载能力。实验结果显示,纯化后的eMigrasome在室温下可稳定保存至少14天,囊泡数量及形态基本不变,仅在去除胆固醇或鞘磷脂等核心脂质后才出现结构崩解。此外,研究者采用基因工程手段将膜蛋白或通过膜锚定策略的胞质蛋白(如OVA、Spike等)高效装载于eMigrasome表面实现精准抗原递送。免疫印迹及荧光成像均证实,工程抗原在eMigrasome中富集程度显著高于母细胞且分布均匀。eMigrasome还表现出良好的包载能力及膜通透性,可实现多类型蛋白、甚至mRNA等生物大分子的递送。这些特性为eMigrasome作为疫苗或药物载体提供了技术支撑。
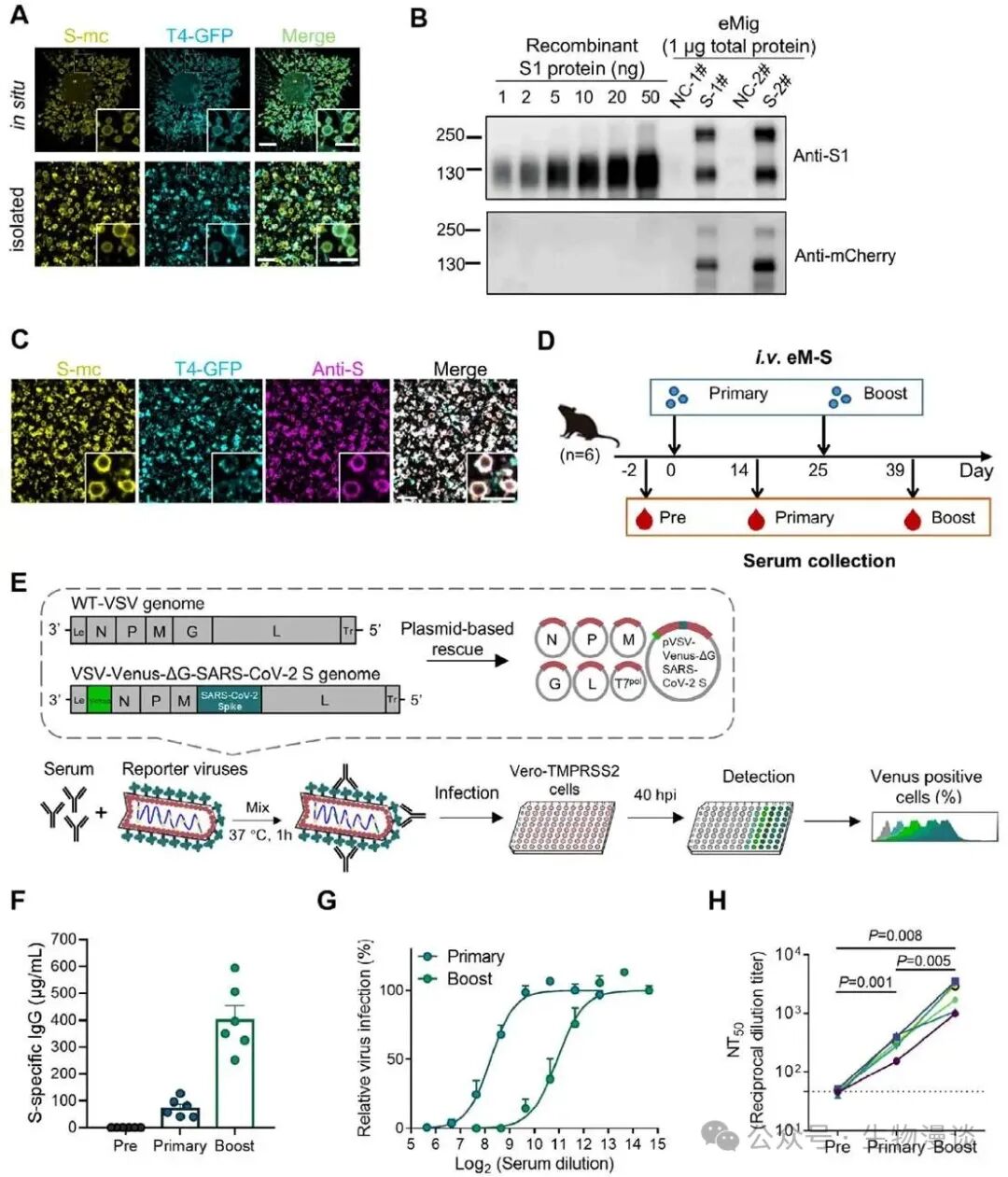
在确认eMigrasome具备良好抗原负载能力与热稳定性的基础上,研究者进一步评价了其作为疫苗平台的免疫效应。以OVA为模型抗原,eM-OVA免疫小鼠可诱导高滴度、多亚型(IgG1/IgG2b/IgG2c/IgG3)抗体应答,免疫反应强度与传统铝佐剂疫苗相当或更优并呈现Th1/Th2平衡型体液免疫特征。更重要的是,即使eM-OVA于室温保存14天其抗原含量及诱导抗体水平均无明显下降。进一步,研究构建了表达新冠S蛋白的eMigrasome(eM-S),经小鼠免疫后可诱导高效中和抗体,且加强免疫后中和效价显著提升能够有效保护小鼠抵御SARS-CoV-2攻击。这些结果表明,eMigrasome平台不仅能稳定装载多种抗原,还能激发强效且多样化的免疫反应,为疫苗研发提供了新模式。
综上所述,本研究通过系统解析迁移体的生物物理特性和分子机制,创新性地开发出一种高效、可控、结构与功能高度拟态天然迁移体的工程化eMigrasome平台。该平台不仅克服了天然迁移体产量低、应用局限的难题,还通过精准抗原负载、出色的室温热稳定性和多样的免疫激活能力成功实现了新型疫苗的功能验证。动物实验证实,eMigrasome疫苗可诱导高效广谱的体液免疫,且对新冠等病毒感染具有保护效果。更为重要的是,eMigrasome作为载体具备极强的可拓展性和安全性,为未来疫苗、药物递送和细胞间通讯等领域的技术突破提供了全新路径。该成果为全球范围内应对冷链受限场景和新型疫苗递送模式奠定了坚实的理论与应用基础。
文献链接:https://doi.org/10.7554/eLife.97621


