张哲研究组与合作者破解葡萄糖-6-磷酸转运蛋白SLC37A4的底物转运与抑制机制
糖原贮积症Ib(GSD-Ib)是一种罕见的常染色体隐性遗传代谢疾病,全球发病率约为十万分之一。该疾病主要由SLC37A4基因突变引起,导致其编码的葡萄糖-6-磷酸(G6P)转运蛋白功能受损,进而引发空腹低血糖、肝肾功能异常、中性粒细胞减少等临床表现。SLC37A4定位于内质网膜,负责将细胞质中的G6P转运至内质网腔,供葡萄糖-6-磷酸酶(G6Pase)催化生成葡萄糖,是糖原分解与糖异生过程中的关键环节,对维持机体血糖平衡及免疫细胞稳态具有重要作用。尽管SLC37A4的生理功能已较为明确,但其在原子水平上如何特异性识别底物G6P与无机磷酸(Pi)、致病突变影响转运活性的结构基础,以及潜在药物分子的抑制机制等核心科学问题,长期以来尚未得到系统阐释。
2025年11月12日,北京大学生命科学学院、生命科学联合中心张哲研究组在Nature Structural & Molecular Biology杂志发表题为“Structural basis of G6P/Pi transport and inhibition in SLC37A4”的研究论文。该研究成功解析了SLC37A4蛋白在五种不同功能状态下的高分辨率结构,包括无底物状态、Pi结合状态、G6P结合状态以及抑制剂S-4048结合状态。这些结构完整捕捉了蛋白质在“cytoplasm-facing”与“lumen-facing”两种构象之间的动态转换过程。结合转运功能实验与分子动力学模拟,研究进一步揭示了SLC37A4通过“rocking-switch”机制实现底物转运的结构基础(图1)。
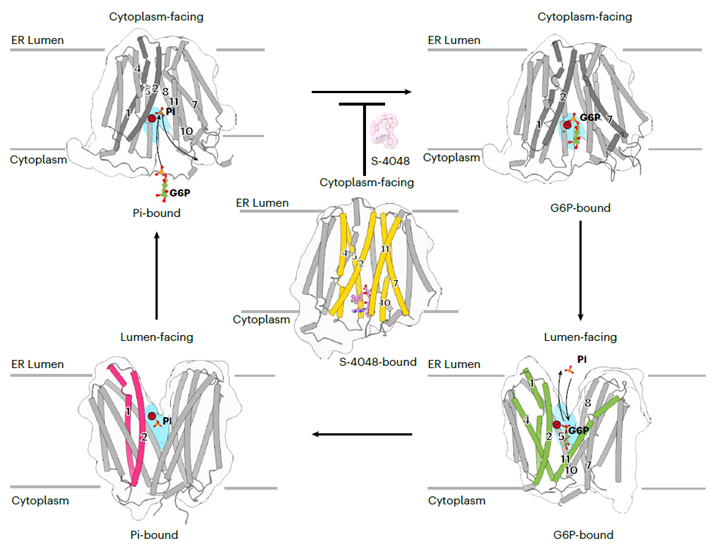
图1. SLC37A4的底物转运与抑制的工作模型
研究还发现,基于天然产物绿原酸(Chlorogenic acid,CHA)改造的高效抑制剂S-4048能够部分占据G6P结合位点,并将SLC37A4锁定在“cytoplasm-facing”构象,从而阻断其转运活性。突变实验进一步阐明了S-4048特异性识别SLC37A4而不作用于其他家族成员(SLC37A1-A3)的结构机制,为后续靶向药物开发提供了关键理论依据。此外,研究团队将已知的GSD-Ib致病突变精准定位至蛋白结构,系统揭示了这些突变通过破坏底物识别、构象转换或蛋白稳定性而导致功能丧失的分子病理机制(图2)。
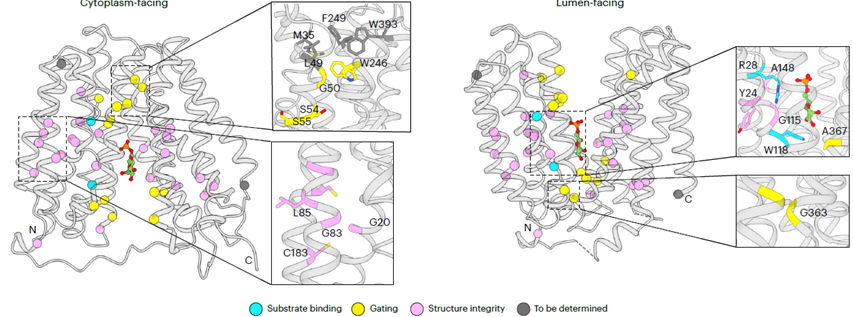
图2. GSD-Ib相关致病突变在SLC37A4蛋白结构上的定位
值得关注的是,中国科学院物理研究所姜道华团队与清华大学陈立功团队此前在Nature Communications上报道了SLC37A4在不同状态下的结构特征;中国科学技术大学刘欣、孙林峰、杨智森团队亦在Nature Structural & Molecular Biology上同期发表了关于SLC37A2转运G6P分子机制的研究,反映出该领域的重要进展。


