Sci Adv | 肖俊宇和高宁研究组联合发表多聚抗体设计策略
时间:2025-11-07
2025年11月6日,北京大学肖俊宇教授与高宁教授研究团队联合在Science Advances上发表了题为“Xenopus IgX informs engineering strategies of IgM and IgG hexamers”的研究论文。本研究在追溯抗体分子演化的过程中,从非洲爪蟾中的IgX抗体得到了启发,开发了一种适用于构建人源IgM和IgG六聚体的策略,为相关大分子药物的设计提供了新思路。
抗体是人体免疫防御系统中的关键分子。IgM抗体在演化上最为古老,广泛存在于有颌脊椎动物中。在哺乳动物中,IgM通过其重链末端18个氨基酸组成的“尾片(tailpiece, tp)”区域与J链结合,组装成稳定的五聚体[1]。这一组装形式不仅维持了IgM五聚体的稳定性,还使得J链以独特的方式参与和 IgM受体、及结合蛋白的相互作用,从而调节IgM的功能[1–4]。在缺乏J链的情况下,IgM可形成部分六聚体及四聚体、五聚体等聚合形式。除了能以多价态的方式结合并中和病原,IgM 还能高效激活补体系统,协同清除病原和异常细胞[5, 6]。值得注意的是,天然IgM六聚体的含量虽然很低,但由于在结构上与C1q的六聚体结构更为匹配,因此比IgM五聚体具有更强的补体激活能力[7–10]。
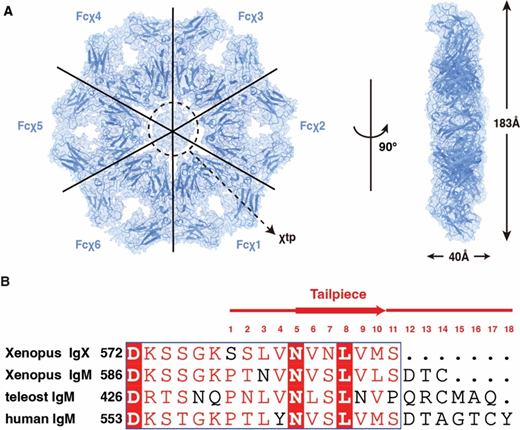
图1. IgX-Fc六聚体的冷冻电镜结构
为了进一步探究χtp 介导六聚体形成的能力,本研究接下来将人源IgM的tp (μtp) 替换为IgX的χtp。结果显示,获得的嵌合体(Fcμ-χtp)在没有J链的情况下,也能高效组装成均一的六聚体。据此结果,推测tp的长度可能是调控六聚体形成的关键。随后,将人源IgM的μtp 逐步截短,发现μtp的长度在11-16个氨基酸之间均可以实现均一的六聚体组装(图2A-B)。从分子机制的角度,少于11个氨基酸的μtp会损害β-折叠的完整性,从而破坏IgM六聚体的稳定性;而超过16个氨基酸的μtp则会因空间位阻效应阻碍六聚体形成。具体而言,倒数第二位的Cys575与末端Tyr576参与IgM-Fc与J链的相互作用,更加有利于 IgM-J五聚体的组装,但会影响六聚体的形成。
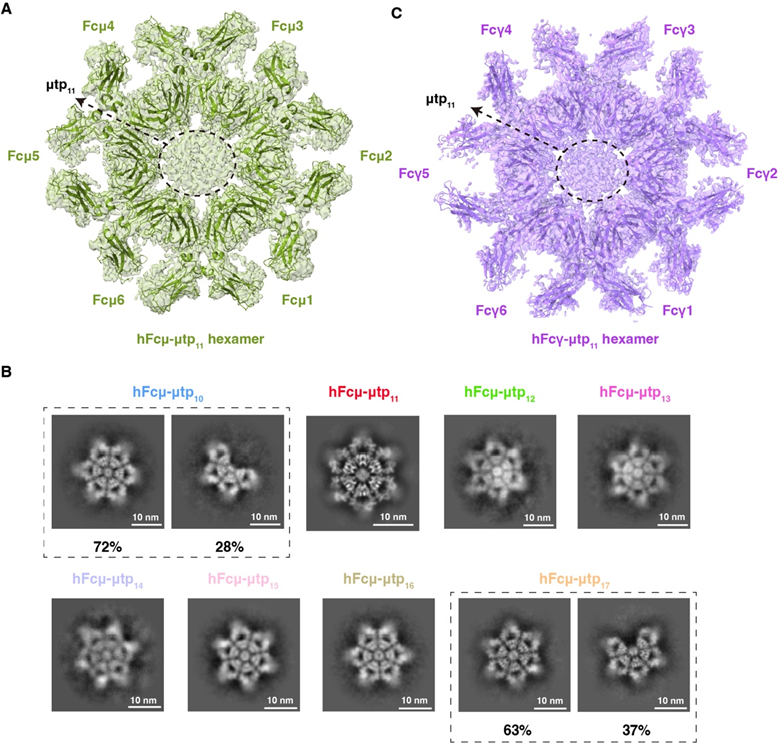
图2. 改造后 IgM-Fc 和 IgG-Fc六聚体的冷冻电镜结构
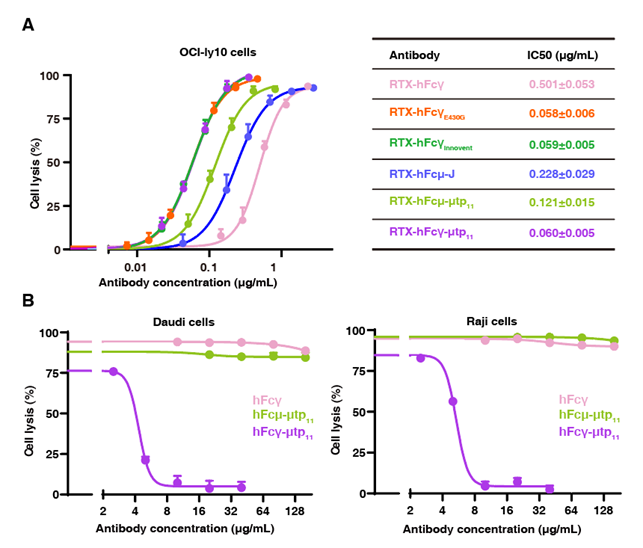
图3. 改造后抗体的功能表征


