Cell | 刘念/李湘盈合作揭示携带二价组蛋白修饰的复合型转座子调控造血系统分化和衰老
2025年8月6日,清华大学生命科学学院、清华-北大生命科学联合中心刘念课题组联合北京大学生命科学学院、北大-清华生命科学联合中心李湘盈课题组在Cell上在线发表了题为Composite transposons with bivalent histone marks function as enhancers in cell fate regulation的研究论文。该研究首次揭示了H3K9me3和H3K27ac标记的二价染色质对复合型转座子SVA的协同调控机理和生物学功能,并证明了SVA的RNA依赖性增强子活性及其在造血系统分化和衰老相关髓系偏好性造血中的重要生理意义,提示其有望成为干预造血发育异常和造血衰老的潜在靶标。

二价染色质(bivalent chromatin)是指基因组上同时被激活性组蛋白修饰和抑制性组蛋白修饰共同标记的染色质区域【1-4】。例如,二价启动子(bivalent promoter),由激活性H3K4me3和抑制性H3K27me3共同标记【3】;静息态增强子(poised enhancer),由激活性H3K4me1和抑制性H3K9me3共同标记【4】。这两类二价染色质对于谱系基因的表达和谱系分化发育的精确调控具有重要作用。然而,人类基因组中是否还有更多类型的二价染色质?这些二价染色质的调控机理和生物学功能是什么?目前尚未得到全面深入的解析。
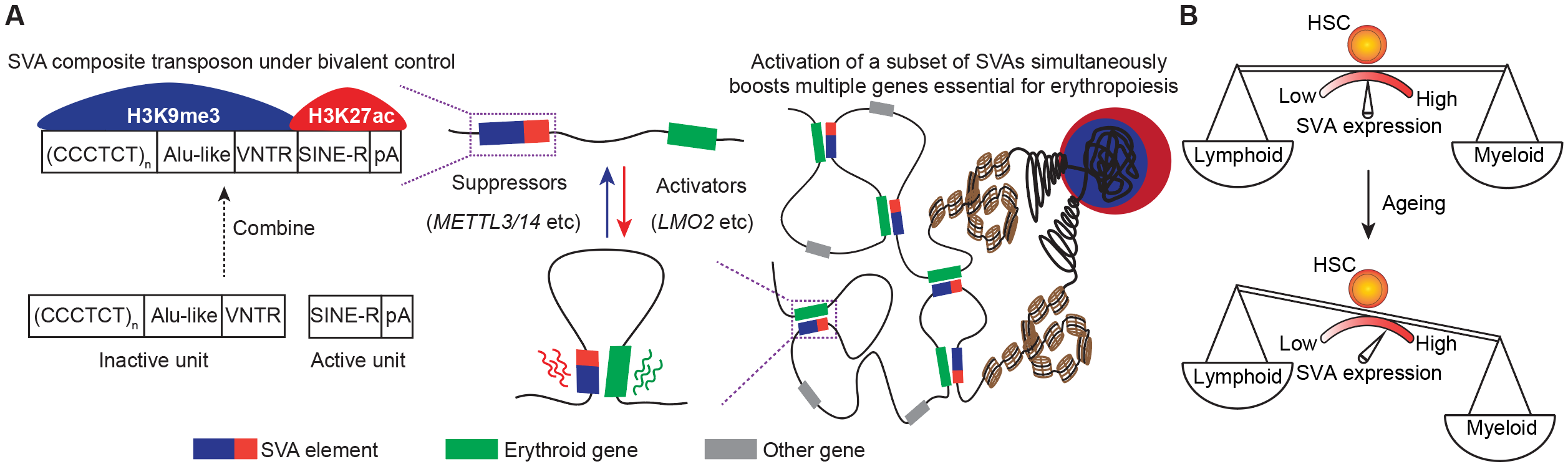
转座元件(Transposable Element, TE;又称为转座子transposon)是基因组中可以发生跳跃的DNA元件,人类基因组中的转座子序列约占45%。长期以来,转座子被认为是基因组中的垃圾序列,然而近年来越来越多的研究发现转座子对于基因组的进化、基因的表达调控等方面具有重要作用。此外,转座子在基因组中的不断插入还可以形成复合型的DNA元件以及新的转录单元,例如,复合型转座子SINE-VNTR-Alu(简称SVA),其序列组成上是由Alu-like序列、串联重复序列VNTR和来源于HERV-K的SINE-R序列等重复序列复合而成。进化上,SVA起源于约2500万年前,是人基因组特异的且最为年轻的一类复合型转座子,已有的体外实验提示其VNTR区域具有异染色质功能,而SINE-R区域具有增强子活性【5-7】。然而,复合型转座子SVA元件上具有不同功能的区域及各自携带的染色质修饰在基因组上是如何被调控的,以及它们之前的协同调控如何影响SVA的转录及生物学功能,目前仍然未知。
为了回答上述问题,研究人员首先通过分析来自3种不同细胞系的组蛋白修饰ChIP-seq数据,包括常见的抑制性组蛋白H3K9me3、H3K27me3和激活性组蛋白H3K27ac、H3K4me1、H3K4me3和H3K9ac,系统性鉴定了人类基因组上不同类型二价染色质的组成和分布,结果发现H3K9me3、H3K27ac共同标记二价染色质在复合型转座子上富集,包括LTR-L1、SVA等,尤其是在SVA上最为富集,且H3K9me3主要分布于SVA的5’端,H3K27ac主要分布于SVA的3’端。进一步分析发现,复合型转座子LTR-L1的表达影响染色质高级结构TAD的边界强度;SVA的表达具有细胞类型特异性,且与其上的二价染色质修饰存在相关性。
为了探究二价染色质对于复合型转座子的调控机理和生物学功能,研究人员以代表性的复合型转座子SVA为研究对象。首先,通过构建SVA的表达报告系统并运用全基因组筛选策略,研究人员找出了SVA的161个抑制因子和237个激活因子,这些调控因子涉及功能多样的调控通路和蛋白互作网络。通过流式和RNA-seq,研究人员验证了其中部分调控因子,并且分析发现具有二价染色质修饰的SVA更倾向于被调控因子所调节。接着,研究人员选取了其中的激活因子LMO2和抑制因子METTL3/14进行了深入探究。结果显示,LMO2通过TAL1结合到SVA的3’端,并招募组蛋白乙酰转移酶CBP在SVA的3’端加上H3K27ac。当LMO2敲除后,SVA的3’端H3K27ac减少,而5’端H3K9me3增加,从而导致SVA表达下调。相反,METTL3/14通过在SVA的RNA上加上m6A修饰,进而招募YTHDC1/SETDB1,在SVA的5’端加上H3K9me3,METTL3/14敲除后,SVA的5’端H3K9me3减少,而3’端LMO2、CBP富集增加,进而使H3K27ac增加,SVA表达升高。
功能上,研究人员发现LMO2或METTL3/14通过调控SVA的表达会影响SVA周围基因的表达,即类似增强子的活性。为了进一步验证SVA的RNA依赖性增强子活性,研究人员通过CRISPRa/i、Hi-C、SVA deletion,、SVA反义核苷酸(ASO)处理等方法,系统验证了SVA依赖其RNA并通过染色质环(chromatin loop)接触并激活远程基因表达的增强子功能。进一步,研究人员在造血干细胞的红细胞分化、髓系/淋系双向分化过程中,发现SVA在包括红细胞分化和单核-巨噬细胞分化在内的髓系分化中表达上调,而在淋系分化中表达下降。且不同的SVA亚群通过与不同谱系的特异性基因形成loop激活相应谱系发育基因的表达。当用ASO敲低SVA的RNA后,造血干细胞分化产生的髓系比例下降而淋系比例升高。最后,研究人员关注到衰老相关的髓系偏好性造血现象,并发现衰老造血干细胞中SVA表达上调是导致衰老造血系统中髓系分化比例偏高的原因。而通过敲低SVA的表达,可以使衰老造血干细胞的髓系/淋系分化比例很大程度地恢复至年轻造血干细胞的水平,从而揭示了SVA对于造血系统分化发育过程及造血衰老中重要生理意义(图1)。
 |
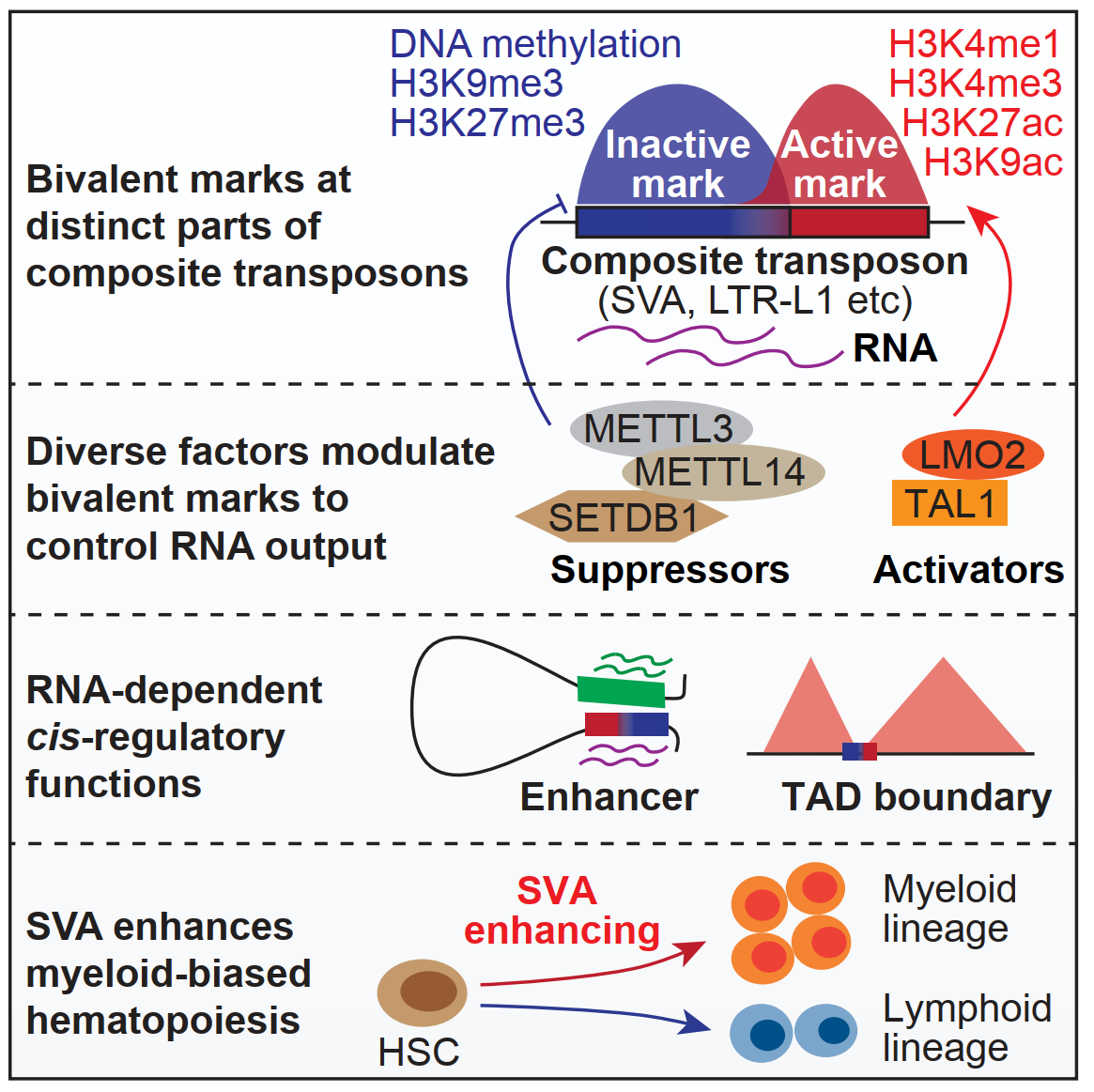 |
图2.论文总结图
清华大学生命科学学院、清华-北大生命科学联合中心的刘念副教授和北京大学生命科学学院、北大-清华生命科学联合中心的李湘盈研究员为该论文的通讯作者,刘念课题组CLS项目2020级博士生周自强和李湘盈课题组2018级博士生朱昰聪(已毕业)为该论文的共同第一作者。
参考文献:
1. Macrae, T.A., Fothergill-Robinson, J., and Ramalho-Santos, M. (2023). Regulation, functions and transmission of bivalent chromatin during mammalian development. Nat. Rev. Mol. Cell Biol. 24, 6–26.
2. Blanco, E., González-Ramírez, M., Alcaine-Colet, A., Aranda, S., and Di Croce, L. (2020). The Bivalent Genome: Characterization, Structure, and Regulation. Trends Genet. 36, 118–131.
3. Bernstein, B.E., Mikkelsen, T.S., Xie, X., Kamal, M., Huebert, D.J., Cuff, J., Fry, B., Meissner, A., Wernig, M., Plath, K., et al. (2006). A Bivalent Chromatin Structure Marks Key Developmental Genes in Embryonic Stem Cells. Cell 125, 315–326.
4. Rada-Iglesias, A., Bajpai, R., Swigut, T., Brugmann, S.A., Flynn, R.A., and Wysocka, J. (2011). A unique chromatin signature uncovers early developmental enhancers in humans. Nature 470, 279–283.
5. Hancks, D.C., and Kazazian, H.H. (2010). SVA retrotransposons: Evolution and genetic instability. Semin. Cancer Biol.20, 234–245.
6. Jacobs, F.M.J., Greenberg, D., Nguyen, N., Haeussler, M., Ewing, A.D., Katzman, S., Paten, B., Salama, S.R., and Haussler, D. (2014). An evolutionary arms race between KRAB zinc-finger genes ZNF91/93 and SVA/L1 retrotransposons. Nature516, 242–245.
7. Robbez-Masson, L., Tie, C.H.C., Conde, L., Tunbak, H., Husovsky, C., Tchasovnikarova, I.A., Timms, R.T., Herrero, J., Lehner, P.J., and Rowe, H.M. (2018). The HUSH complex cooperates with TRIM28 to repress young retrotransposons and new genes. Genome Res.28, 836–845.


