此项工作不仅发现了一种全新的程序性细胞坏死机制,即由RIP3-CaMKII通路介导的、不依赖于经典的RIP1-RIP3-MLKL通路的程序性坏死,而且发现CaMKII是一种新的RIP3激酶底物。 本研究成果拓展了人们对程序性细胞坏死调节机制的基本认识,同时为重大心血管疾病包括心脏缺血和缺氧损伤、恶性重构和心力衰竭的预防和治疗提供新靶点和新途径。 Nature Medicine, 2016;22:175-182.
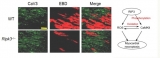
肖瑞平研究组发现受体相互作用蛋白3 (RIP3) 通过活化钙/钙调素依赖的蛋白激酶II (CaMKII),参与心脏缺血和氧化应激引起的心肌细胞程序性坏死的调节过程。该工作于2016年1月5日在线发表于《Nature Medicine》杂志。 心肌细胞的坏死和凋亡在包括心肌梗死、缺血/再灌损伤和心力衰竭等多种心脏病理过程中发挥重要作用。过去30多年的研究绝大多数都集中在心肌细胞的凋亡过程,但是对心肌细胞坏死的调节机制知之甚少。 肖瑞平研究组的工作发现RIP3的缺失,能够预防缺血和氧化应激引起的心肌细胞的程序性坏死,而过表达RIP3则足以引起心肌细胞的坏死。 与已知的多种细胞的程序性坏死不同,RIP3引起的心肌细胞坏死不需要RIP1和MLKL的参与,而是通过激活CaMKII,进而造成心肌细胞的程序性坏死以及后续的恶性心脏重构和心力衰竭。RIP3是通过直接磷酸化和活性氧依赖的间接氧化,引起CaMKII的活化的。同时RIP3-CaMKII信号通路还参与心肌细胞的凋亡和炎症过程。
此项工作不仅发现了一种全新的程序性细胞坏死机制,即由RIP3-CaMKII通路介导的、不依赖于经典的RIP1-RIP3-MLKL通路的程序性坏死,而且发现CaMKII是一种新的RIP3激酶底物。 本研究成果拓展了人们对程序性细胞坏死调节机制的基本认识,同时为重大心血管疾病包括心脏缺血和缺氧损伤、恶性重构和心力衰竭的预防和治疗提供新靶点和新途径。 Nature Medicine, 2016;22:175-182.
