因此,在高等动物体内有一套严格的负反馈调控机制,通过SREBP (Sterol Regulatory Element-Binding Protein)通路,调控胆固醇的摄取及合成,控制血液及细胞内的胆固醇含量。在SREBP通路中,内质网上的二次跨膜蛋白SREBP2的氨基端结构域是调控胆固醇合成与摄取相关基因的转录因子。Insig是位于内质网上的一类含有六次跨膜螺旋的膜蛋白,在结合类固醇分子(如25-羟基胆固醇,简称25HC)的情况下,可以通过Scap介导,与SREBP2形成复合物,将SREBP2滞留在内质网上,从而降低细胞内胆固醇的合成和摄取。尽管对于SREBP通路的细胞生物学与生物化学性质有了相当多的认识和理解,但受限于真核膜蛋白在纯化、结晶等方面的技术难度,这个领域的结构生物学研究异常缓慢。
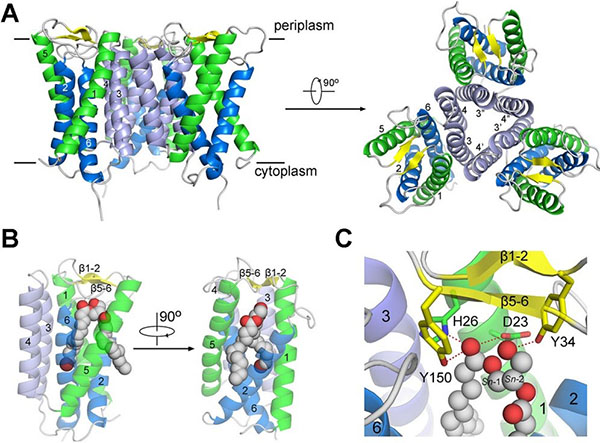
颜宁研究组通过序列分析发现Insig蛋白在七种分支杆菌中有同源蛋白,她们将Mycobacterium vanbaalenii中的同源蛋白命名为MvINS,并解析了其分辨率高达1.9 Å的晶体结构。通过结构分析,推测MvINS可能结合一种重要的脂类小分子二酰基甘油(DAG),并最终获得了分辨率为2.1 Å的MvINS/DAG复合物结构。随后作者基于MvINS的晶体结构,通过同源建模构建了人源Insig的三维结构模型,在此基础上设计大量的Insig突变体检验与Scap的相互作用,从而推测出25HC与Insig可能的结合区域,以及Insig与Scap可能的相互作用界面。这项研究结果为高等生物Insig蛋白的结构生物学和生物化学研究提供了有力的支持,对进一步研究Insig在SREBP通路的作用以及工作机理具有重要的意义。
颜宁教授自2007年回国旋即开展了针对SREBP通路的系统的结构生物学与生物化学研究,近年终于取得一系列进展。这是她们继2015年3月在《细胞研究》(Cell
Research)报道了酵母中SREBP通路的Scap蛋白调控结构域结构(http://www.nature.com/cr/journal/v25/n4/full/cr201532a.html)之后的又一重要成果。