蛋白质和线粒体的质量控制对细胞基本活力的维持至关重要。细胞中的蛋白质稳态主要通过分子伴侣蛋白系统与两个蛋白水解系统,即泛素-蛋白酶体系统和自噬-溶酶体系统的协调运作来维持;而作为细胞的能量和代谢中心,线粒体具有相对独立的质量控制系统,包括分子水平的氧自由基清除系统、分子伴侣蛋白系统和蛋白酶系统以及细胞器水平的融合/分裂机制和线粒体自噬机制等。蛋白质稳态的失衡和线粒体的功能障碍是衰老和衰老相关疾病发生的重要因素,二者的发生可能互为因果,但它们之间相互联系的具体机制尚不清楚。
陈佺研究员课题组发现,定位于线粒体外膜的线粒体自噬受体蛋白FUNDC1能够与定位于胞浆的分子伴侣蛋白HSC70相互作用。胞浆中损伤或错误折叠的蛋白可通过该相互作用被募集到线粒体上,之后通过TOM-TIM复合体进入线粒体基质并被定位于基质的线粒体蛋白酶LONP1降解。当细胞中蛋白酶体的活性受到抑制时,FUNDC1与HSC70的相互作用增强,进入线粒体的非折叠蛋白也相应增加。如果这些蛋白在线粒体基质中不能被及时清除,则会参与形成一种特异的多层膜结构。
由FUNDC1和HSC70介导的新途径可以通过启用线粒体自身的蛋白酶系统或线粒体自噬机制来帮助细胞维持蛋白质稳态,但是非折叠蛋白在线粒体上的过度积累会损害线粒体的完整性,激活AMPK并导致细胞衰老的发生。因此,这种由线粒体介导的蛋白质补偿性降解方式是以牺牲线粒体自身的正常功能以及细胞的健康和活力为代价的。
该项研究结果在蛋白稳定失衡、线粒体功能障碍和细胞衰老之间建立了新的联系,为衰老及衰老相关疾病的发生原因提供了新的解释,为这些疾病的治疗和预防提供了新的理论指导。
论文链接:http://emboj.embopress.org/content/early/2018/12/21/embj.201798786。
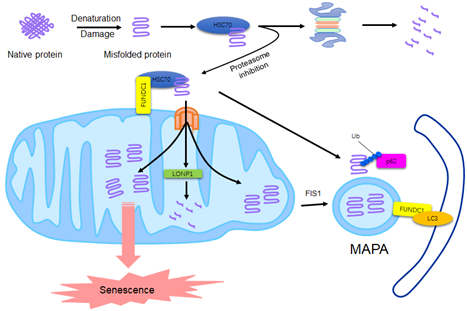
图. 由自噬受体蛋白FUNDC1与分子伴侣蛋白HSC70相互作用介导的蛋白质补偿性降解机制





