2024年6月11日,张哲课题组在Cell Research杂志发表了题为“VAChT神经递质识别与抑制的结构研究”(Structural insights into VAChT neurotransmitter recognition and inhibition)的研究论文。该项工作报道了人源VAChT蛋白分别与底物乙酰胆碱以及抑制剂vesamicol结合的冷冻电镜结构。结合分子动力学模拟以及功能实验,本研究阐明了VAChT识别底物和抑制剂的分子机制(图1)。
本课题组利用此前在囊泡单胺转运蛋白VMAT2(SLC18A2)研究中所开发的蛋白改造方法(Pidathala et al. Nature2023),成功解析了VAChT与vesamicol以及底物乙酰胆碱结合的冷冻电镜结构。在这些结构中,VAChT均呈现MFS超家族转运蛋白的经典lumen-facing构象。Vesamicol结合在VAChT中带负电的口袋。通过比较VAChT和VMAT2的底物结合模式,作者进一步提出,整个SLC18家族蛋白均利用一个保守的酸性氨基酸残基识别底物中带部分正电的胆碱或氨基基团,而二者则利用结合位点处几个不保守的氨基酸残基实现了对各自底物的特异性选择。总之,该研究加深了人们对VAChT乃至整个SLC18家族蛋白底物识别机制的理解,并为针对vesamicol和VAChT的药物设计提供了重要参考。
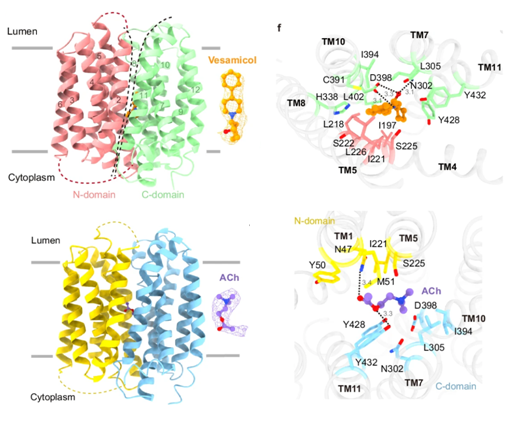
图1. VAChT识别抑制剂vesamicol和底物乙酰胆碱(ACh)的分子机制
Cell Res34, 665–668 (2024). https://doi.org/10.1038/s41422-024-00986-5





