研究案例
本文是陈晔光院士团队发表在Stem Cell Reports上题为“Non-muscle myosin heavy chain 9 maintains intestinal homeostasis by preventing epithelium necroptosis and colitis adenoma formation”的研究论文,本文章虽然不算大手笔,但是为我们做类器官相关的文章提供了很好的思路参考。非肌肉肌球蛋白 IIA 在细胞粘附、细胞迁移和组织结构中起着重要作用。我们之前表明,非肌肉肌球蛋白 IIMyh9 重链的低活性有利于 LGR5 肠道干细胞的维持。然而,Myh9 在成年小鼠肠上皮中的功能尚不清楚。在本研究中,我们使用诱导型 Villin-creERT2 敲除方法删除成年小鼠肠道上皮中的 Myh9,并观察到 Myh9 的纯合缺失导致肠道结肠炎样形态变化,导致对葡聚糖硫酸钠的高度敏感性并促进结肠炎相关腺瘤的形成。结肠 Myh9 缺失会扰乱细胞连接并损害肠腔屏障的完整性,促进上皮细胞的坏死性凋亡。始终如一地,Ripk3knockout 可以部分挽救这些变化。我们的结果表明,Myh9 是维持肠上皮完整性和防止细胞坏死所必需的。

INTRODUCTION
肠上皮由单层细胞组成,其经历快速更新并从隐窝基底移动到绒毛尖端。肠干细胞 (ISC),称为柱状基底细胞,位于隐窝的底部,并由 LGR5 标记(Barker 和 Clevers,2010 年;Barker 等,2007 年)。隐窝还包含一种中间细胞类型——反式放大 (TA) 细胞,在分化为成熟的上皮细胞之前,会经历四到五轮细胞分裂,包括肠上皮细胞、杯状细胞、肠内分泌细胞和潘氏细胞 (Barker, 2014) .与其他分化细胞相比,Paneth 细胞位于隐窝基部并与 LGR5 ISC 混合,LGR5 ISC 是 LGR5 ISC 生态位的重要组成部分,并通过产生表皮生长因子、转化生长因子 WNT3A 促进 ISC 维持, 和 Notch 配体 DLL4 (Sato et al., 2011)。
患有炎症性肠病的人患结直肠癌和结肠炎相关癌症的风险增加。近年来,炎症性肠病 (IBD) 的发病率迅速上升,引起了社会对肠道炎症的关注(Terzic 等,2010;Waljee 等,2017)。肠腔屏障的破坏或病原体的出现都会导致结肠炎。RIPK3 依赖性坏死性凋亡的激活可引起肠道炎症(Dannappel 等人,2014 年;Gunther 等人,2011 年;Wang 等人,2020 年;Welz 等人,2011 年),并且有人提出上皮细胞死亡成为肠道炎症的标志(Anderton 等,2020;Kaser 等,2010;Patankar 和 Becker,2020)。用 DSS 或结合氧化偶氮甲烷 (AOM) 治疗小鼠可以产生快速有效的结肠炎相关癌症模型(Parang 等,2016)。在溃疡性结肠炎中特别观察到 RIPK3MLKL 轴的激活。炎症促进癌症发展的分子机制尚不清楚,可能与其他形式的结直肠癌不同(Grivennikov,2013;Terzic 等,2010)。
非肌肉肌球蛋白 II (NMII) 是一种肌动蛋白结合蛋白,包含两条重链和两对轻链。在哺乳动物中,肌球蛋白重链 9 (Myh9) 是编码 NMII 重链的三个基因之一,在细胞粘附、细胞迁移和组织结构中起着关键作用(Conti 和 Adelstein,2008 年;Vicente-Manzanares 等人, 2009)。NMII 已被证明可介导胚胎和诱导多能干细胞的解离诱导失巢凋亡(Chen 等人,2010 年;Ohgushi 等人,2010 年;Walker 等人,2010 年)。我们之前的研究表明,在 DSS 治疗后,Myh9 在小鼠远端结肠的上皮损伤部位积聚,而 Myh9 单等位基因缺失可改善 DSS 诱导的结肠炎(Zhao 等,2015)。这些结果表明Myh9在肠道炎症过程中起重要作用。在本研究中,为了进一步解决 Myh9 在成年小鼠肠上皮中的功能,通过使用诱导条件 Myh9敲除(KO),我们发现成年小鼠肠上皮中 Myh9 的完全缺失会导致结肠炎样形态学变化,减少干细胞,增加坏死性凋亡,导致对 DSS 的高度敏感性,并促进结肠中结肠炎相关腺瘤的形成。此外,通过额外删除 Ripk3 抑制坏死性凋亡使小鼠结肠炎的病理特征较少。因此,Myh9 至少部分地通过抑制 RIPK3 来阻止坏死性凋亡来维持肠道稳态。
RESULTS
Myh9deficiency results in impaired villus and abnormal cryptsMyh9 缺乏导致绒毛受损和隐窝异常
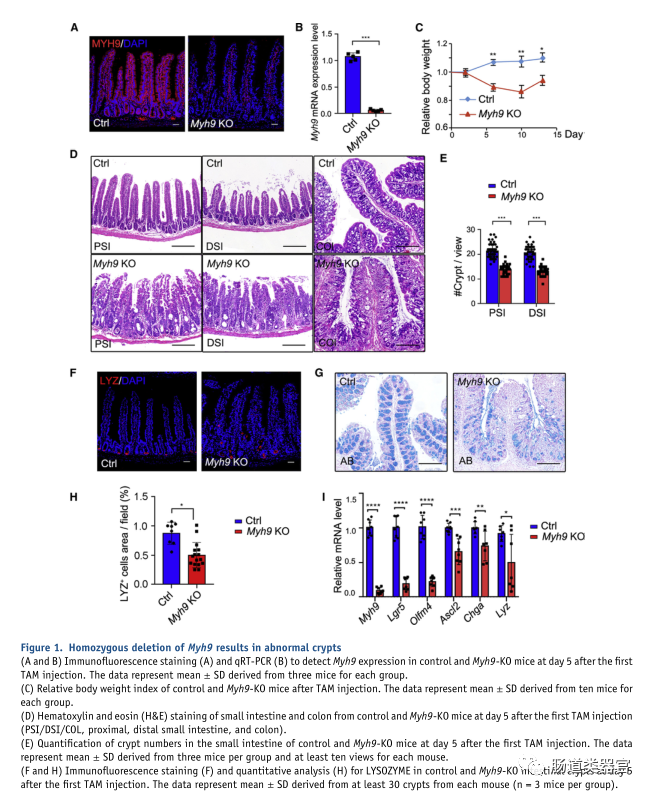
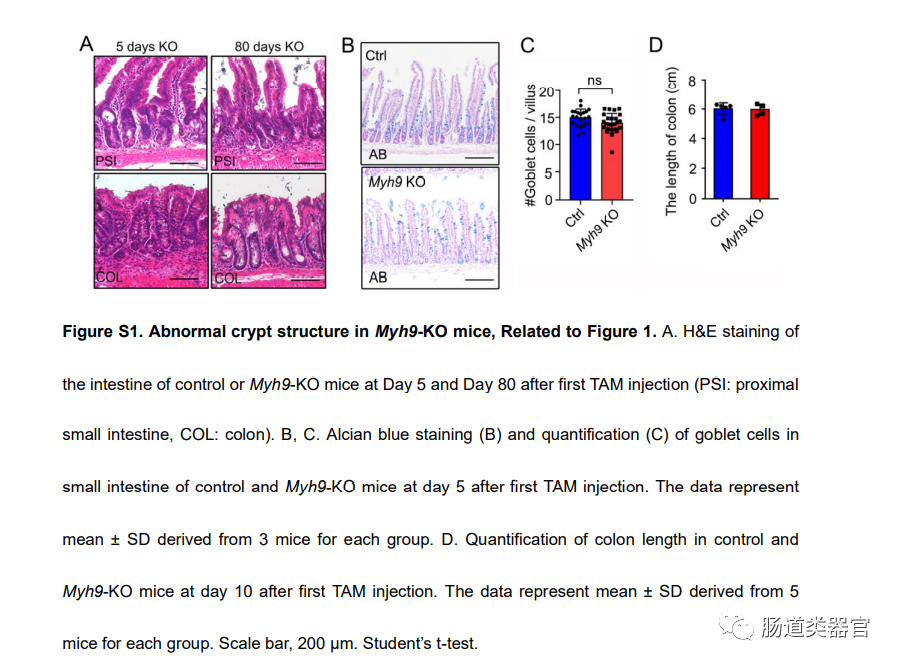
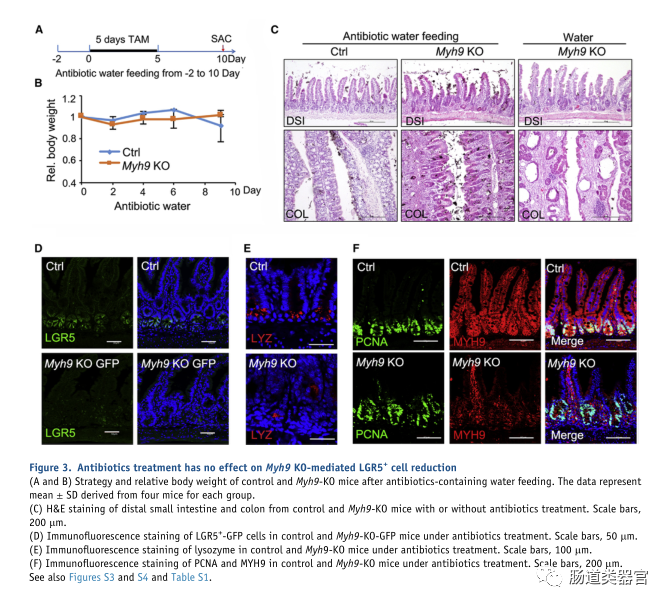
在之前的一项研究中,我们发现 Myh9 与 Villin-Cre 的单等位基因缺失可以促进 LGR5 细胞的存活和增殖(Zhao 等,2015)。由于我们无法获得两个等位基因中具有 Villin 驱动的 Myh9 纯合缺失的成年小鼠,我们将 Myh9fl/flmice 与 VilinCreERT2 小鼠杂交以产生可诱导的条件敲除小鼠 Myh9fl/fl;Villin-CreERT2(Myh9-KO)。连续 5 天每天注射他莫昔芬 (TAM) 后,免疫荧光和 qRT-PCR 显示 Myh9 在敲除小鼠肠道中被有效消耗(图 1A 和 1B)。Myh9-KO 小鼠的体重在 TAM 注射后第 2 天开始下降,并在 TAM 注射后第 14 天保持低于对照小鼠(图 1C)。在不同时间点在小肠中观察到异常扩张的隐窝和空腔(图 1D 和 S1A)。小肠中的隐窝数也减少了(图 1E)。更严重的是结肠,很明显,Myh9-KO 结肠中的隐窝更少,浸润更多。在小肠中,Myh9-KO 小鼠的 Paneth 细胞减少和脱位(图 1F 和 1H)。此外,Myh9-KO 小鼠结肠中杯状细胞的数量显着减少(图 1G),而它们在小肠中没有变化(图 S1Ba n d S1C)。qPCR 分析显示 ISC 标记基因的表达,如 Lgr5、Olfm4、n dAscl2、大量 Paneth 细胞标记溶菌酶 (Lyz) 和肠内分泌细胞标记嗜铬粒蛋白 A (Chga),在 Myh9-KO 隐窝中降低(图 1I)。Myh9-KO 小鼠的所有形态变化,如异常隐窝、杯状细胞减少和体重减轻,都与 DSS 诱导的结肠炎小鼠的表型相似(Cooper 等人,1993 年;Wang 等人,2020 年;Wirtz等,2007)。然而,Myh9-KO 小鼠的结肠长度没有变化(图 S1D)。
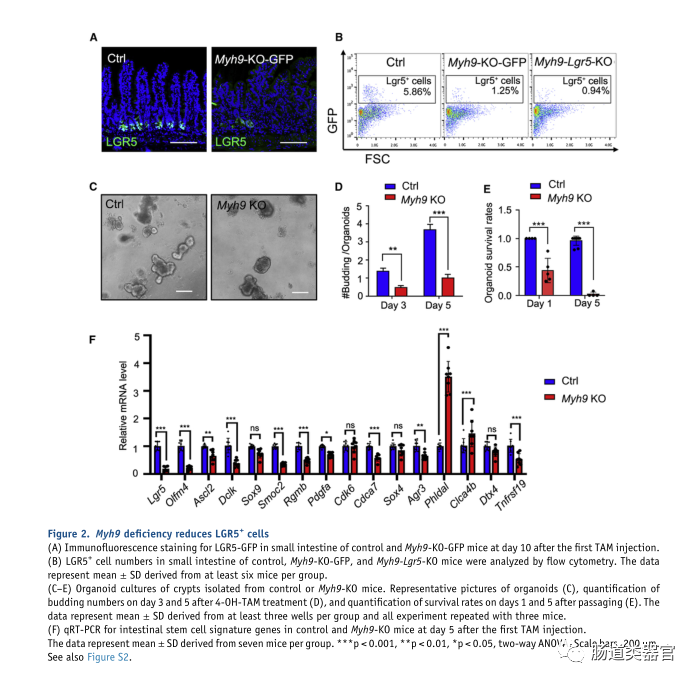
Myh9plays an important role in LGR5+cell maintenanceMyh9 在 LGR5 细胞维持中起重要作用
由于 Myh9 缺失后 LGR5 ISC 标记基因表达显着降低,我们随后评估了 Myh9 缺陷是否影响 LGR5 ISC 维持。我们将 Myh9fl/fl;Villin-CreERT2 小鼠与 Lgr5-GFP-IRESCreERT2 小鼠杂交以产生 Myh9-KO-GFP 小鼠。从免疫荧光和流式细胞术分析中,我们检测到 TAM 诱导的 Myh9 缺失后 Myh9-KOGFP 小鼠中 LGR5 细胞的显着减少(图 2A)。此外,Myh9fl/fl 中 LGR5 ISC 中的特定 Myh9 缺失;Lgr5-GFP-IRES-CreERT2 小鼠(Myh9-Lgr5-KO)也导致 LGR5 ISC 减少(图 2B),表明 Myh9 对 LGR5 ISC 维持至关重要。为了进一步证实 Myh9 在 LGR5 ISC 维持中的作用,我们培养了来自 Myh9-KO 小鼠隐窝的类器官,并在播种后的第二天通过 4-羟基三苯氧胺 (4-OH-TAM) 诱导 Myh9 缺失。培养 3-5 天后,我们发现 Myh9?/?organoids 中的出芽少于对照(图 2C 和 2D)。此外,传代后存活的类器官较少(图 2E),这与 Myh9 的单等位基因缺失形成对比,后者促进了类器官的存活(Zhao 等,2015)。一致地,大多数 ISC 特征基因的表达在 Myh9 删除后降低(图 2F)。这些结果表明适量的Myh9对于体内LGR5 ISC维持和体外类器官存活很重要。
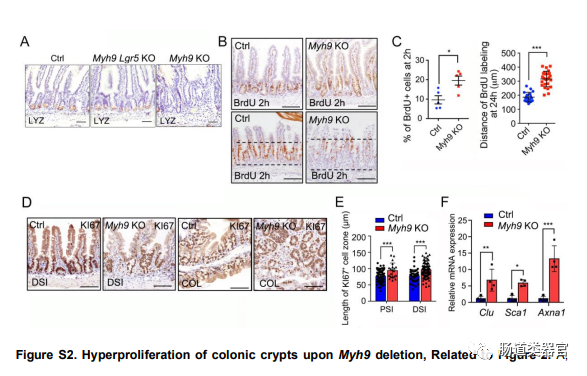
尽管 Paneth 细胞在维持 LGR5 ISC 方面发挥着关键作用(Sato 等人,2011),但 LGR5 细胞中的 Myh9 缺失(Myh9-Lgr5-KO)显着减少了 LGR5 ISC,其程度与 Myh9-KO-GFP 小鼠相同(图 2B ),表明 Myh9 缺失诱导的 LGR5 ISC 减少是 LGR5 细胞自主效应。一致地,LGR5 细胞中的 Myh9 缺失不影响 Paneth 细胞(图 S2A)。
此外,我们使用溴脱氧尿苷 (BrdU) 标记增殖细胞,发现 Myh9KO 导致更多增殖细胞,并且 Myh9KO 肠道中大多数 BrdU 标记的细胞迁移到绒毛区(图 S2B 和 S 2 C)。K I 6 7 染色还显示 Myh9KO 后小肠和结肠隐窝中的增殖率更高(图 S2D 和 S2E)。越来越多的研究表明,在上皮损伤后,分化的上皮细胞或祖细胞可以去分化,恢复其增殖能力,甚至成为 ISC 以补偿丢失的上皮细胞(Barriga et al., 2017; Li et al., 2016; Liu 和 Chen,2020;Liu 等,2020;Schmitt 等,2018;Tetteh 等,2016;Wang 等,2019;Yan 等,2017;Yu 等,2018)。Clu、Sca1、Anxa1等几种再生基因的表达增强(图S2F),表明由于Myh9KO诱导的损伤的补偿,扩增的增殖细胞可能是TA细胞或祖细胞。这些数据表明,Myh9 缺陷减少了 LGR5 细胞群,同时导致增殖细胞的扩增。
The Myh9 deficiency-induced decrease of ISCs and Paneth cells is independent of microbiotaMyh9 缺陷诱导的 ISC 和 Paneth 细胞减少与微生物群无关
Myh9-KO 小鼠的肠道形态变化、隐窝变形、LGR5 ISC 减少、杯状细胞减少和 Paneth 细胞移位,类似于结肠炎的病理特征(Cooper 等,1993)。对照和 Myh9-KO 小鼠上皮的转录组图谱也显示炎症相关基因在 Myh9-KO 小鼠的小肠上皮中富集(图 S3A)。此外,Myh9 缺失后,更多的中性粒细胞(以 CD11b 标记)被募集到隐窝区域(图 S3B)。Myh9KO 使肠上皮容易受到 2.5% DSS 诱导的结肠炎的影响,如严重的体重减轻所示(图 S3C),并且 Myh9KO 结肠是与对照组相比,更短的侵蚀区域(图 S3D 和 S3E)。
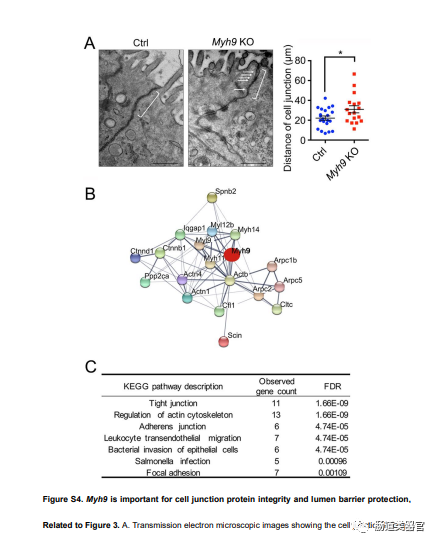
由于 Myh9 参与肌动蛋白丝与细胞连接的连接并在肠上皮屏障通透性中起重要作用(Naydenov 等人,2016 年;Vicente-Manzanares 等人,2009 年),我们推断其缺乏可能会影响细胞连接的完整性和促进细菌入侵,从而削弱 LGR5 ISC 维持和使 Paneth 细胞脱位。透射电子显微镜检查显示 Myh9 缺陷导致隐窝中的细胞连接丢失(图 S4A)。此外,抗 MYH9 沉淀蛋白的质谱分析鉴定了 380 种潜在的相互作用蛋白,包括细胞连接和肌动蛋白相关蛋白(图 S4B;表 S1)。KEGG 通路分析显示前 5 条通路是紧密连接、肌动蛋白细胞骨架、粘附连接、白细胞跨内皮迁移和细菌入侵(图 S4C)。因此,Myh9-KO 小鼠的炎症可能与失去细胞连接的中性粒细胞浸润有关。
为了检查结肠炎样表型是否是由细菌入侵引起的,我们在将小鼠置于无菌条件下前 2 天用含有广谱抗生素的水喂养小鼠,然后在第 10 天将它们杀死前注射 TAM(图3A)。抗生素治疗有效地挽救了 Myh9-KO 小鼠的体重减轻(图 3B)。虽然异常隐窝的形态变化在肠道中得到缓解(图 3C),但 LGR5 ISCs 和 Paneth 细胞的减少以及增殖细胞的扩增并没有通过抗生素治疗来挽救(图 3D-3F)。这些结果表明 LGR5 ISC 丢失、Paneth 细胞错位和隐窝中增殖细胞的扩增与细菌入侵无关。
Myh9 deficiency promotes cell necroptosis of intestinal epithelium Myh9缺陷促进肠上皮细胞坏死
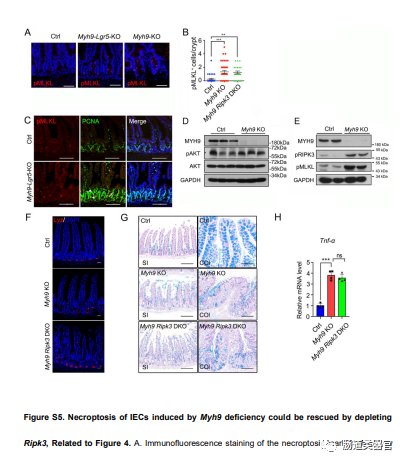
为了进一步研究 Myh9 缺陷如何导致异常隐窝结构和 LGR5 ISC 丢失,我们通过 TUNEL 测定检查了细胞死亡,发现 Myh9-KO 小鼠的隐窝中有更多标记细胞(图 4A)。由于 RIPK3 介导的 ISC 坏死性凋亡与肠炎有关(Gunther 等人,2011 年;Welz 等人,2011 年),我们检测了 pRIPK3 和 pMLKL 的水平,并发现它们在 Myh9-在Myh9-KO小鼠和Myh9-Lgr5-KO小鼠的隐窝上皮中观察到KO小鼠(图4B和4C)和更多的pMLKL细胞(图S5A和S5B)。此外,一些 PCNA 和 pMLKL 细胞共定位于 Myh9-Lgr5-KO 小鼠的隐窝中,表明在 Myh9 缺失后增殖细胞中也可能发生坏死性凋亡(图 S5C)。相比之下,在 Myh9KO 隐窝中观察到切割的 caspase-3 显着减少(图 4C)。先前的研究强调,Myh9 单等位基因缺失会激活 AKT,这对 LGR5 干细胞的存活至关重要(Zhao 等,2015)。在这里,我们发现 p-AKT 基本保持不变(图 S5D)。此外,抗生素喂食不会降低 Myh9-KO 小鼠的 pRIPK3 和 pMLKL 水平(图 S5E)。
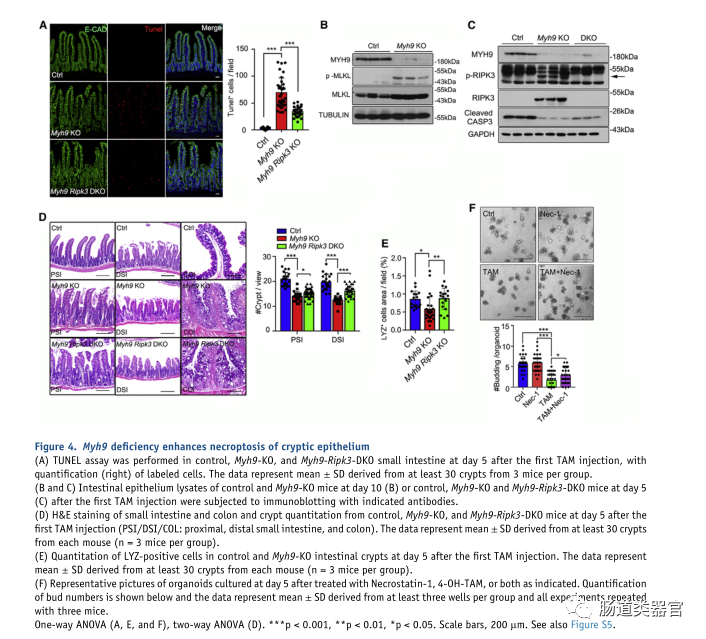
为了证实缺乏 Myh9 的上皮细胞发生 RIPK3-MLKL 依赖性坏死性凋亡,我们将 Ripk3?/?小鼠与 Myh9-KO 小鼠杂交以阻断坏死性凋亡 (Myh9-Ripk3-DKO)。与 Myh9-KO 小鼠相比,Myh9-Ripk3-DKO 小鼠的上皮细胞死亡细胞数量大大减少(图 4A)。因此,隐窝和 Paneth 细胞的结构明显恢复(图 4D、4E 和 S5F)。然而,杯状细胞和肿瘤坏死因子α表达在Myh9-KO和Myh9-Ripk3-DKO小鼠中是相同的(图S5G和S5H)。此外,RIPK1 抑制剂 Necrostatin-1 可以有效阻断 Myh9 缺失诱导的类器官死亡(图 4F)。在对照小鼠的上皮中可检测到 MYH9 对 RIPK3 的募集;然而,Myh9 的基因消融导致与 RIPK3 相互作用的丧失(表 S1)。所有这些数据表明,Myh9 缺陷诱导的肠上皮细胞死亡主要是通过坏死性凋亡。
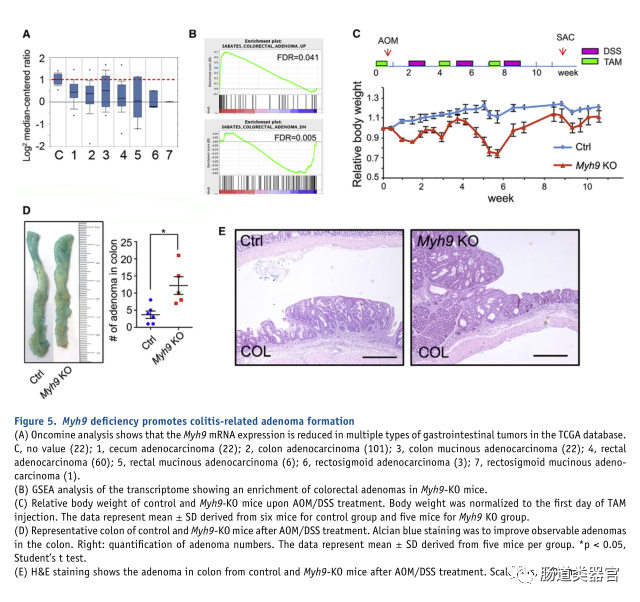
Myh9deficiency promotes colitis-related adenoma formation in the colonMyh9缺陷促进结肠中与结肠炎相关的腺瘤形成
据报道,Myh9 是鳞状细胞癌中的肿瘤抑制因子(Schramek 等TCGA 数据库的 Oncomine 分析显示 Myh9 在大多数类型的胃肠道腺瘤/癌中下调(图 5A)。此外,转录组分析显示结直肠腺瘤相关基因在 Myh9KO 肠上皮中富集,并且这些基因在结直肠腺瘤和 Myh9KO 上皮中显示出相似的表达模式(图 5B)。由于 IBD 患者患结肠炎相关发育不良和癌症的风险很高(Grivennikov,2013;Terzic 等,2010),我们使用 AOM/DSS 诱导的腺瘤模型来探索 Myh9 在肠道癌变中的作用。小鼠用一次 AOM 注射治疗,然后用 TAM 注射五次,然后用 5 天恢复,5 天 DSS 喂养,重复三次。AOM-DSS 治疗导致 Myh9-KO 小鼠体重下降(图 5C)。Myh9KO小鼠结肠中腺瘤的数量显着增加(图5D)。然而,如 H&E 染色所示,Myh9-KO 小鼠中的肿瘤没有侵袭性,2014)(图 5E)。这些数据表明,Myh9 在维持上皮完整性和防止病理性炎症和癌变方面发挥着关键作用。
DISCUSSION
在这项研究中,我们证明了肠上皮中 Myh9 的可诱导纯合缺失导致异常隐窝、对 DSS 诱导的结肠炎形成的高度敏感性以及结肠炎相关腺瘤的发展。Myh9 缺陷导致隐窝上皮细胞连接丢失和肠上皮坏死。阻断坏死性凋亡可以部分挽救 Myh9-KO 小鼠的表型,包括隐窝异常和减少的 Paneth 细胞。我们之前的研究表明,降低 Myh9 表达水平或抑制其活性可以通过增强 Akt 激活和改善 DSS 诱导的结肠炎来促进 LGR5 ISC 的自我更新(Zhao 等,2015)。然而,这项研究表明,肠上皮中的纯合 Myh9 缺失损害了 LGR5 细胞。原因可能是坏死性凋亡信号的强烈激活克服了激活的生存信号。LGR5 细胞中 Myh9 的特异性缺失也减少了它们的细胞数量,表明 Myh9 对保护细胞至关重要来自坏死性凋亡的干细胞。Myh9 缺陷引起的 ISC 减少的另一种可能性可能是 Myh9KO 隐窝中的潘氏细胞功能不足。Paneth 细胞通过提供多种配体构成维持 LGR5 ISC 的生态位(Sato 等,2011;Takeda 等,2011)。我们观察到 Villin-driven Myh9deletion 减少了 Paneth 细胞数量。如前所述,细胞连接蛋白,例如 E-钙粘蛋白缺乏,或坏死性凋亡的激活,都会影响 Paneth 细胞的位置和数量(Gunther 等,2011;Schneider 等,2010;Welz 等, 2011)。有趣的是,LGR5 细胞中 Myh9 的特异性缺失并未影响 Paneth 细胞的数量,表明 ISC 减少主要是由这些细胞内的 Myh9 缺陷引起的。
细胞连接完整性是肠腔屏障稳定的基础,对于细胞间通讯和保护免受病原体入侵和炎症反应很重要(Buckley 和 Turner,2018 年;Odenwald 和 Turner,2017 年;Suzuki,2013 年)。Myh9,一种与肌动蛋白丝,参与细胞粘附、极化和迁移(Conti 和 Adelstein,2008 年;Vicente-Manzanares 等人,2009 年)。与较早的报告(Naydenov 等,2016)一致,我们发现 Myh9 的缺失损害了细胞连接蛋白的表达和分布,并影响了上皮屏障的完整性。我们的数据与 E-钙粘蛋白通过提供粘附连接的机械完整性在肠上皮细胞正常功能中的重要性一致(Bondow 等人,2012 年;Mohanan 等人,2018 年;Schneider 等人,2010 年) )。





