细胞自噬是一种由溶酶体介导的细胞内降解途径,在进化上非常保守,其生物学功能涉及诸多方面,与生物的生长发育、衰老、以及人类重大疾病等密切相关(图1)【1-3】。自噬调控基因鉴定的前驱大隅良典教授于2016年获得了诺贝尔生理医学奖。细胞自噬的一个核心步骤是双层膜自噬体的形成,该过程需要内膜系统提供膜来源,并通过内膜形变的方式产生自噬体膜前体。内膜系统如何转变成自噬体是自噬领域多年来的谜题之一。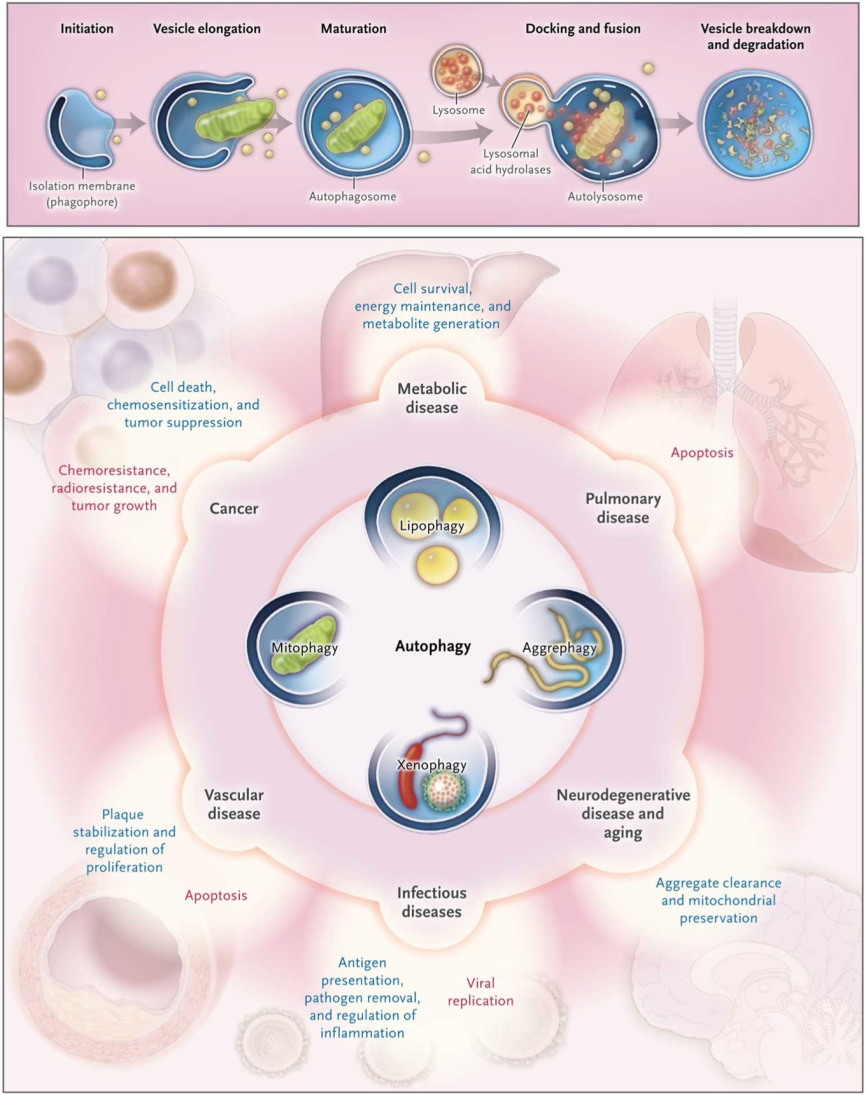 图1(引自参考文献3)
图1(引自参考文献3)
要回答以上问题首先要弄清楚自噬体来源于哪些细胞器。在过去的几十年中,许多研究聚焦于揭示自噬体的膜来源。很多细胞器也被初步认定为膜来源,如:内质网、高尔基体、细胞质膜等【4】。但是这些研究主要依靠亚细胞共定位来判定某一细胞器和自噬体的关联性,一直缺少因果式的证据。葛亮博后期间在Randy Schekman实验室通过体外重建自噬体膜形成的系统,发现内膜系统中的内质网-高尔基体中间体(ER-Golgi intermediate compartment, ERGIC)可以直接促进自噬体膜的产生,提供了自噬膜来源因果式证据,并随后发现ERGIC通过产生一类新型COPII小泡(ERGIC-COPII),为自噬体提供膜来源【5,6】。相关研究工作被多个实验室重复验证【7-9】。随后发现饥饿状态下细胞内质网(ER)上的ERES(ER-Exit Site)重塑,然后似乎和ERGIC 产生一定联系促进自噬体的形成【10】。但是有几个至关重要的问题没有解答:(1)在细胞内诸多细胞其中为什么选择ERGIC作为自噬体膜的来源?(2)ERGIC 和ERES是如何相互协作产生自噬体的?
2021年9月24日,清华大学葛亮研究组在Cell Research期刊在线发表了题为 A new type of ERGIC-ERES membrane contact mediated by TMED9 and SEC12 is required for autophagosome biogenesis 的研究论文,报道了一条由TMED9和SEC12蛋白相互作用介导的ERGIC-ERES新型内膜互作调节自噬体膜形成的分子通路。
作者通过体外重建自噬体的脂化系统、膜泡分离和质谱鉴定,发现ERGIC蛋白TMED9在调控自噬体产生过程中发挥重要的作用。TMED9缺失细胞内自噬体产生水平下降。电镜显示APEX2标记的TMED9-ERGIC膜和双层膜自噬体紧密关联(图2a)。先前研究发现饥饿条件下ERES产生形变并和ERGIC 发生联系,该过程调节自噬。作者发现TMED9缺失的细胞中ERGIC(ERGIC53)和ERES(SEC12)之间的距离变大,提示TMED9调控ERGIC和ERES之间的相互关系(图2b)。这个结论也被3D多色STORM(与许可实验室合作)成像支持。结果显示TMED9在饥饿条件下定位于ERGIC和ERES的交界处(图2c)。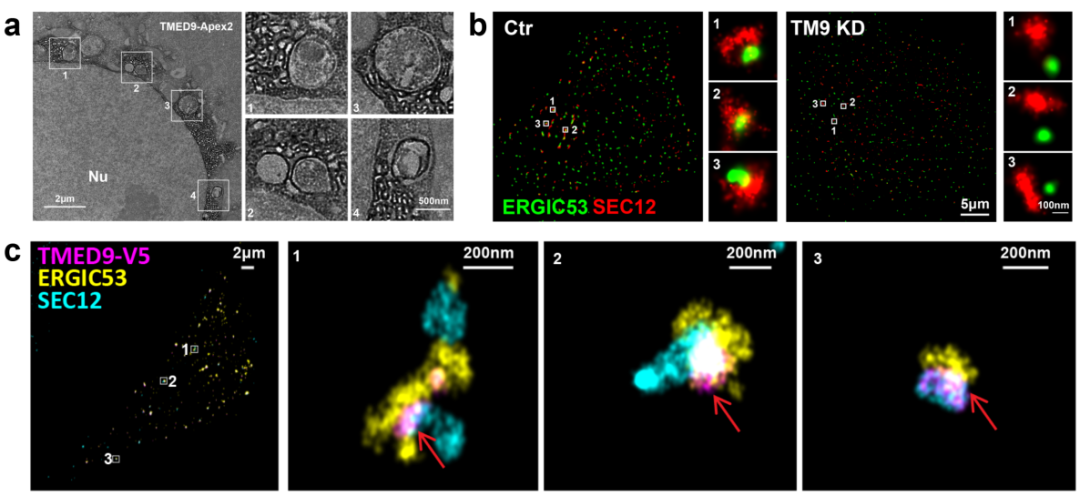
图2
以上结果提示,TMED9参与调节饥饿状态下ERGIC-ERES之间的相互联系。TMED9是如何调节该过程的呢?作者发现ERGIC上的TMED9通过结合ERES上的SEC12,促使一类新型内膜互作ERGIC-ERES互作的形成。作者利用SD-SIM活细胞成像(与陈良怡实验室合作)对于ERGIC-ERES互作动态进行了分析(视频1,白点显示互作位点),发现其互作时间(20-30s)较传统膜互作更短(如:ER-mitochondria互作~1-5min 【11】; peroxisome-lysosome 互作~100s【12】)。通过电子断层扫描3D重构(与李赛实验室合作),作者对于ERGIC-ERES互作面分析(视频2,ERES红色,ERGIC绿色),发现ERGIC-ERES互作面的最短距离可以达到2-5 nm,比传统的细胞器膜互作(10-30 nm)距离更小,提示ERGIC-ERES互作有独特的功能。确实,作者发现ERES上的SEC12可以通过短距离互作接触到ERGIC膜,实现在ERES上反式催化ERGIC-COPII小泡的形成从而调节自噬体膜的产生。此外,ERGIC-ERES互作也会调节SEC12从ERES到ERGIC的转位顺式催化ERGIC-COPII产生。
该工作发现了ERGIC关键蛋白TMED9作为自噬调控因子调节新型内膜ERGIC-ERES互作,在自噬体产生中其重要作用,解答了以上两个重要问题。结合先前的一系列工作,作者提出了一个TMED9介导的ERGIC-ERES新型膜互作促进自噬体形成的分子通路。其中,饥饿刺激通过影响SEC12与FIP200以及CTAGE5的互作导致ERES重塑。ERES重塑促进TMED9与SEC12的结合,直接介导了ERGIC-ERES膜互作的形成,可以为SEC12从ERES到ERGIC的转移提供便利条件,而且由于接触非常紧密,位于ERES上的SEC12可以直接反式激活ERGIC上COPII的产生。通过以上两种方式,ERGIC可以在饥饿等胁迫条件下产生COPII自噬小泡,为自噬体的形成提供充足膜来源(图3)。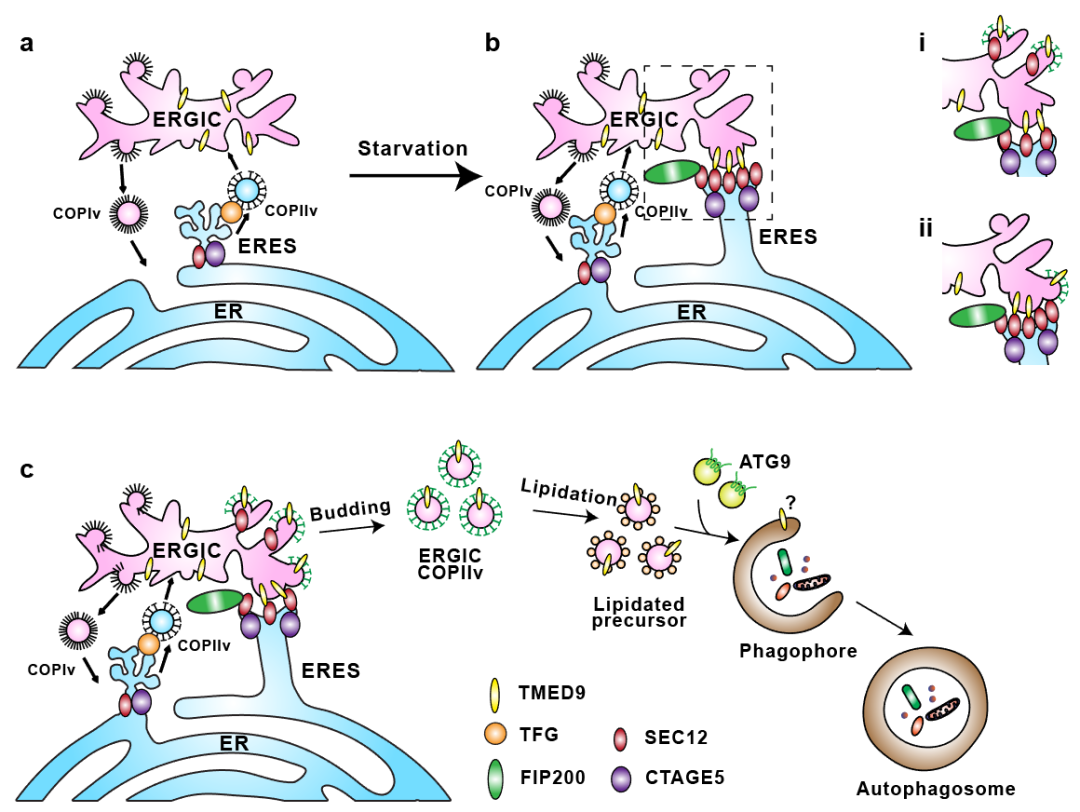
图3
TMED9属于 TMED(transmembrane emp24 domain-containing (TMED) proteins)家族的一员,此家族中另外一个蛋白TMED10被发现介导THU (TMED10-channeled UPS) 通路在蛋白质非经典分泌途径中发挥重要功能【13】(详见BioArt报道:Cell丨葛亮团队揭示非经典分泌蛋白进入膜泡的分子机制)。
该研究由清华大学生命学院葛亮实验室完成。实验室2019级生命学院博士生李树林是文章的第一作者,葛亮副教授为通讯作者。此外,北京大学陈良怡教授实验室、加州大学伯克利分校许可教授实验室、浙江大学孙启明教授实验室、清华大学李赛教授实验室和刘俊杰教授也对该工作提供了重要帮助。
原文链接:https://www.nature.com/articles/s41422-021-00563-0





