2022年11月28日,俞立教授团队在Nature Cell Biology上发表文章Monocytes deposit migrasomes to promote embryonic angiogenesis,在这项研究中,研究者观察到鸡胚绒毛尿囊膜(CAM)上存在一群高度迁移的细胞,并大量形成迁移体(图一)。通过单细胞测序和抗体染色,发现这群高度迁移的细胞是单核细胞。去除单核细胞导致毛细血管形成受损,这表明这些细胞在血管新生中起重要作用。进一步的机制研究表明单核细胞产生的迁移体能够在体内、外模型中诱导血管新生。在鸡胚绒毛尿囊膜中敲低或敲除TSPAN4可阻断单核细胞迁移体的形成, 并导致毛细血管新生的抑制。有意思的是,单核细胞产生的迁移体可以在体外和体内募集单核细胞,敲低或敲除TSPAN4显著减少了毛细血管形成区域中的单核细胞数量。研究者进一步发现迁移体促进血管新生的机制是迁移体高度富集VEGFA和CXCL12。迁移体分别通过释放CXCL12和VEGFA来募集单核细胞和促进血管新生。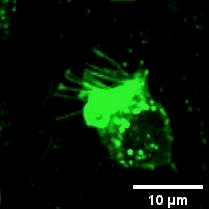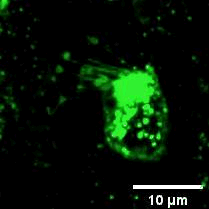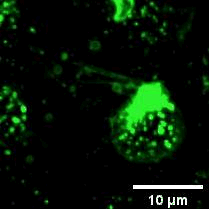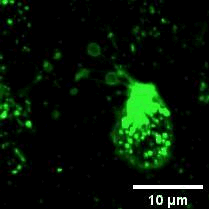
图一:CAM单核细胞迁移时产生迁移体。
众所周知,VEGF特定梯度分布和浓度分布实现对血管形态模式的调控,而其特定浓度梯度的形成,除了高度本地化的基因表达模式外,还依赖于对糖胺聚糖肝素(glycosaminoglycan heparin)的高亲和力,结合肝素的能力被认为是VEGF等这些分泌分子沉积在细胞外基质或细胞表面能力的体现【15】。而本文这项工作显示迁移体以一种全新机制产生了VEGF信号模式和信号梯度。使用迁移体作为信号源来指导血管新生具有多种优势。首先,迁移体为VEGF等血管新生因子提供了一个有时空特异性的信号载体,从而创造出一个由单核细胞迁移路径决定的信号结构模式。其次,多种不同种类的血管新生因子可以包装到同一个迁移体中。这些因素可能通过不同血管生长因子之间的同步释放,确保血管新生不同调节机制的空间和时间协调。最后,从迁移体释放血管新生因子需要迁移体破裂或渗漏。这会产生延迟效应,并提供更多机会来微调信号模式的形成。该项工作强调了单核细胞在胚胎发育过程中血管新生中的重要性。基于这些发现,作者提出了血管新生的“先锋”模型,其中单核细胞作为先行者和领路人,通过沉积富含血管新生因子的迁移体,在毛细血管形成之前为血管新生准备有利的微环境(图二,图三)。

图二:In vivo水平,单核细胞引导血管新生方向和路径(黄色:血管;蓝色:单核细胞;红色:单核细胞运行轨迹)。
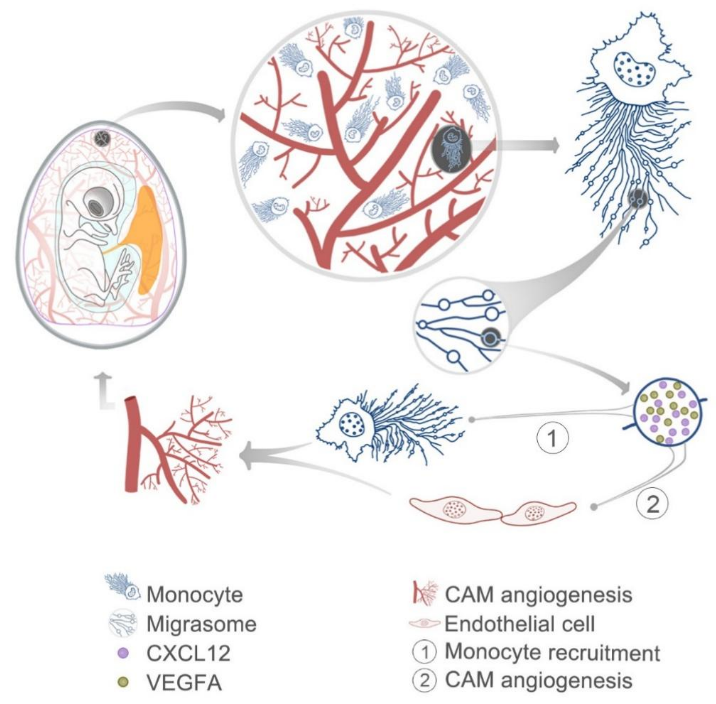
图三:单核细胞作为血管新生“先锋模型”的模式图。
这项工作首次报告了单核细胞在鸡胚绒毛尿囊膜(CAM)上作为designer规划路径,在其迁移轨迹上沉积大量富含促血管新生因子的迁移体,建立了血管新生因子VEGF等的浓度梯度,并实现时空调控,进而促进CAM的血管新生和毛细血管网的建立。单核细胞作为血管新生领路人和路径规划者的这一“先锋模型”为生命过程中信号模式的形成机制提供了全新的思路。
清华大学生命科学学院俞立教授为该论文的通讯作者。博士后张翠芳为该论文的第一作者。
原文链接:https://doi.org/10.1038/s41556-022-01026-3





