2021年12月8日,北京大学未来技术学院分子医学研究所陈雷课题组,在Nature杂志发表题目为 Structural basis of inhibition of the human SGLT2-MAP17 glucose transporter 的文章,报导了人源SGLT2-MAP17复合物与抑制剂恩格列净结合的2.95Å冷冻电镜结构。
SGLT2分子量仅为~73 kDa,附属亚基MAP17为单次跨膜的膜蛋白。二者均没有明显的可溶区结构域。利用冷冻电镜技术解析SGLT2-MAP17异源二聚体的结构具有挑战。作者们经过多年积累和摸索,创新性地采用“三接头固定”的策略将GFP融合在SGLT2胞内的loop区,将GFP纳米抗体融合在MAP17胞内端,利用GFP和nanobody的高亲和力成功地把GFP-nanobody复合物嵌合在SGLT2-MAP17胞内侧,从而为冷冻电镜单颗粒重构提供了指示性标记。作者在克服了蛋白纯化,纳米盘组装、冷冻样品制备和数据处理等一系列困难之后,最终获得了SGLT2-MAP17复合物和抑制剂结合的分辨率为2.95 Å的电子密度,并搭建了原子模型。
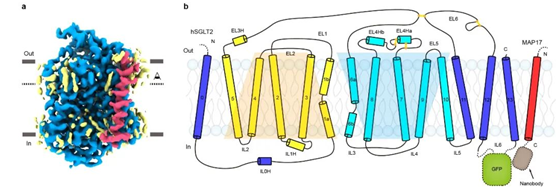
图1. SGLT2-MAP17蛋白的电子密度图和拓扑示意图
SGLT2为14次跨膜蛋白,其中TM1-10为转运的核心结构,TM1-5和TM6-10在拓扑上为反向重复的结构,转运的核心结构和原核生物亮氨酸转运蛋白(LeuT)类似。TM0,TM11-13在核心结构的周围,附属亚基MAP17通过疏水相互作用与TM13结合(图1)。此外,作者还发现,真核生物SGLT家族蛋白在胞外葡萄糖入口的上面,有一个盖子样的结构,此结构由四对二硫键来稳定(图2)。在胞内侧,长的IL6与IL1和IL5发生相互作用(图2),这些相互作用可能对SGLT2的功能非常重要。
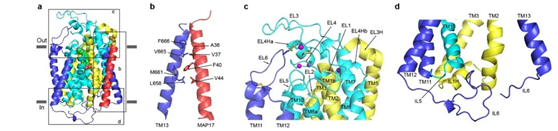
图2. SGLT2和MAP17的相互作用及真核生物SGLT2特异的特征
抑制剂恩格列净结合在SGLT2蛋白的中间,抑制剂的葡萄糖基占据了葡萄糖的结合位点,葡萄糖基的羟基与SGLT2的氨基酸发生了极性相互作用。抑制剂的糖苷配基从葡萄糖结合位点往外延伸,直到蛋白外侧,将SGLT2锁定在向外开放状态(outward-open)(图3)。抑制剂的氯苯基和SGLT2的H80相互作用,中间的苯基与SGLT2的F98、V95、L84和F453通过疏水相互作用,末端的四氢呋喃基团和SGLT2的F98、L274氨基酸相互作用(图3)。作者将SGLT2的F98和F453分别突变为丙氨酸发现,突变的SGLT2降低了和抑制剂的结合,减弱了抑制剂的抑制作用。此外,作者还将和抑制剂结合的SGLT2氨基酸突变为SGLT1对应的氨基酸,发现抑制剂的抑制效果也减弱。这在一定程度上解释了恩格列净对SGLT2相较于SGLT1的高选择性。
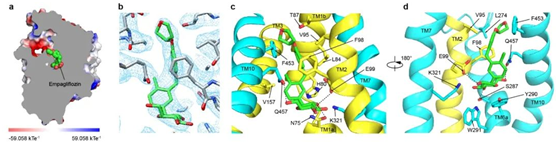
图3. 抑制剂恩格列净的结合位点
作者捕捉到的与抑制剂结合的SGLT2的向外开放状态和原核生物vSGLT的向内开放状态有很大的差别。在向外开放状态的SGLT2中,葡萄糖的出口是关闭的。通过与vSGLT结构的比较发现,TM1、TM2、TM6和TM7的移动是SGLT2葡萄糖出口打开的关键。
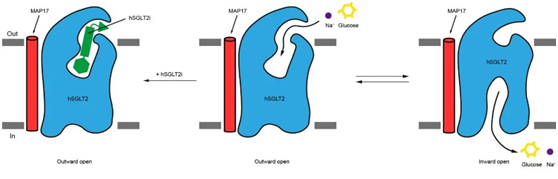
图4. SGLT2抑制剂的工作机制模式图
综上所述,作者通过冷冻电镜对SGLT2-MAP17复合物和抑制剂的结构进行解析,发现抑制剂将SGLT2锁定在向外开放状态,确定了SGLT2抑制剂的结合位点,阐释了抑制剂抑制SGLT2的工作机制(图4),为SGLT家族抑制剂的进一步优化提供了结构基础。
值得一提的是,Nature同期背靠背发表另一篇来自斯坦福大学冯亮和Georgios Skiniotis团队的文章 Structure and mechanism of the SGLT family of glucose transporters ,报道了人源SGLT1和同家族的钠-单脂肪酸共转运蛋白SMCT1的近原子分辨率冷冻电镜结构。同时还配发了来自瑞典斯德哥尔摩大学David Drew撰写的News & Views,高度评价了这两项紧密相关的家族蛋白的工作机理。





