近日,孙育杰组在EMBO Reports杂志上发表文章Golgi-associated microtubules are fast cargo tracks and required for persistent cell migration ,通过结合3D-STORM超分辨成像和活细胞单分子追踪技术,首次基于成像方法在细胞间期区分了中心体微管和GaMTs,并系统研究了GaMTs的性质和功能。研究发现,与中心体微管相比,GaMTs具有更少的微管缺陷,这使囊泡在其上运动时会产生较少的停顿或转向;此外,GaMTs的几何学分布更具有极性且指向细胞前缘;且GaMTs的物理性质更稳定。这些特征令GaMTs成为高速公路,使post-Golgi囊泡能够快速到达细胞前缘前缘并促进细胞的持续性迁移。
首先,作者对细胞中央微管起源区域附近的微管进行3D-STORM成像,在排除了来自离焦层的信号干扰之后,对微管进行了位置相关的分类(GaMTs与non-GaMTs)。接着,结合活细胞单分子追踪技术,研究人员追踪了单根微管上的囊泡运输。有趣的是,研究人员发现在GaMTs上运动的囊泡平均速度更快;相反,non-GaMTs的囊泡则倾向于做小范围的受限运动。随后作者探究了GaMTs介导囊泡更快速运输的可能机制。微管的晶格缺陷可能导致驱动蛋白不能顺利载着囊泡通过而出现停顿或转向事件。作者对比了两种微管的损伤后修复的位点的差异,发现GaMTs比non-GaMTs具有更少的微管缺陷。重要的是,在缺陷位点处囊泡也倾向于产生停顿和转向。这意味着GaMTs上的囊泡将会避免产生停顿和转向,获得更快的平均速度。另外,在几何分布上,GaMTs更加具有极性,且方向指向细胞迁移的前沿;在微管的物理性质上,GaMTs更加能抵御物理化学原因引起的微管解聚。所以,相对于non-GaMTs,GaMTs具有更少缺陷,更有极性,且更稳定,可以帮助囊泡更快的运输到细胞迁移前沿。
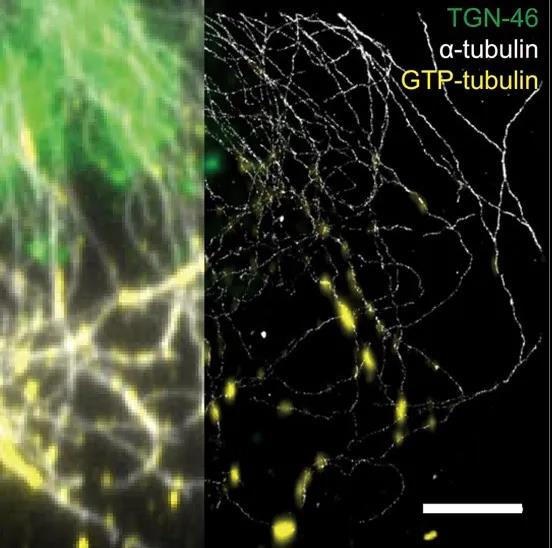
 图1:GTP-tubulin perfusion assay标记的微管损伤后修复的位点(黄色),发现GaMTs(红色微管)损伤位点明显少于non-GaMTs(绿色微管)
图1:GTP-tubulin perfusion assay标记的微管损伤后修复的位点(黄色),发现GaMTs(红色微管)损伤位点明显少于non-GaMTs(绿色微管)
接下来,作者深入研究了GaMTs介导囊泡快速运输的生物学意义。作者首先揭示了GaMTs在细胞迁移中的精确功能。利用光遗传学手段,作者通过控制光照的角度和时间把细胞迁移分离成两个独立的事件:转向和持续迁移。研究发现GaMTs仅仅影响细胞的持续迁移过程,而并不影响细胞的方向改变。对细胞迁移中的囊泡运输分析表明:不论是敲低GaMTs还是post-Golgi囊泡E-cadherin的表达量,都造成细胞持续迁移能力显著减弱;而破坏掉GaMTs会导致post-Golgi囊泡无法正常运输至细胞前缘。这说明,囊泡运输到细胞前沿对维持细胞迁移至关重要,而这一过程是依赖GaMTs的。最后,作者进一步探索了哪些类型的囊泡是依赖GaMTs进行运输的,在进行了4种囊泡的研究之后,作者发现GaMTs-依赖的主要是post-Golgi囊泡的运输,而非recycling囊泡。
图2:GaMTs是囊泡运输的高速公路,且维持细胞持续迁移
总之,相对于中心体微管,GaMTs具有更少的微管缺陷,更具有几何极性且更稳定,这些特征使得GaMTs 成为囊泡运输到细胞前缘的高速公路,维持细胞的持续性迁移。该研究让人们首次看到了微管拥有不同的运输囊泡的能力。本文也阐述了细胞迁移维持的新机制,这为将来重要的生理病理的研究提供了理论基础。未来,研究两种不同功能的微管的形成机制与调控机制将会非常必要。
原文链接:https://www.embopress.org/doi/pdf/10.15252/embr.201948385





