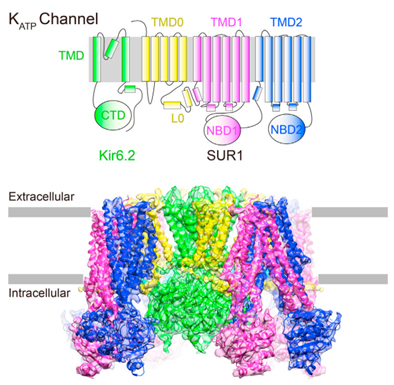
生物体进化出多种方式来感知细胞内能量状态,从而维持能量稳态。KATP通道可以在细胞内ATP水平升高时关闭,从而使钾离子无法外流,进而使膜的兴奋性增加。通过这种方式,它们将细胞内的代谢水平转化为电信号。这些离子通道广泛的分布于很多组织中,并且参与多种生命过程。在胰岛β细胞中,KATP可以间接的感受血糖浓度,控制胰岛素的释放:当血糖升高时,由于β细胞对血糖的主动摄取和代谢,细胞内ATP浓度升高,ATP直接结合在KATP上并抑制其活力,使钾离子无法外流,导致细胞膜的去极化,从而激活电压门控的钙离子通道,进而导致钙离子的内流。钙离子浓度的升高会引起胰岛素的释放,从而降低血糖浓度。KATP的突变会导致很多遗传性代谢疾病。例如,KATP的抑制剂可以用于治疗二型糖尿病,其激活剂可以用于治疗高胰岛素症。
KATP是一个异源八聚体膜蛋白,分子量在880kDa左右。通过冷冻电镜的方法,陈雷研究组和高宁研究组联合解析了KATP蛋白在别构抑制剂药物格列本脲结合状态下的结构,分辨率为5.6?。该结构清晰的显示了KATP的组装模式,提出了KATP被抗糖尿病药物格列本脲别构抑制以及被PIP2别构激活的可能机制。