重要性
上世纪四五十年代,英国科学家霍奇金和赫胥黎发现了动作电位;之后发现电压门控钠离子通道(Nav通道)引发动作电位,而电压门控钾离子通道(Kv通道)则终结动作电位,恢复至静息状态。自此科学界展开了针对钠通道方方面面延续至今的系统研究;可以说,对钠通道的研究构成了过去60多年电生理研究的重要基石。
钠通道是所有动物中电信号的主要启动键,而电信号则是神经活动和肌肉收缩等一系列生理过程的控制基础。在人体中,一共有九种已知的电压门控钠离子通道亚型,在不同的器官和生理过程中发挥作用。钠通道的异常会导致一系列与神经、肌肉和心血管相关的疾病,特别是癫痫、心律失常和持续性疼痛或者无法感知痛觉等;迄今已经在人体的九种钠通道蛋白中发现了一千多个与已知疾病相关的点突变。此外,钠通道也是许多局部麻醉剂以及自然界中大量的神经毒素的直接靶点,许多蛇毒、蝎毒、蜘蛛毒素等,都是作用于钠离子通道而产生不良后果。
钠通道是诸多国际制药公司的研究靶点,有着巨大的制药前景。获取钠通道的精细三维结构对于理解其工作机理以及制药至关重要。
技术难度
除了作为膜蛋白通常具有的技术难度之外,对于真核钠通道高分辨率三维结构的解析还存在着几道额外的很难逾越的“路障”。
首先,获取蛋白样品难。真核生物钠离子通道蛋白全长包含约2000个氨基酸,很难对其像电压门控钾离子通道那样进行大量的体外重组表达;内源钠通道通常含量极低,很难像电压门控钙离子通道那样从生物组织直接纯化出足够的用于结构解析的高质量蛋白样品。
其次,钠通道是由一条肽链折叠而成,具有假四次对称特征。与同源四聚体的钾通道相比,钠通道很难结晶或者利用冷冻电镜技术获取结构;它们又不像钙通道那样与辅助亚基形成较大分子量的稳定复合体,从而增大了利用电镜技术解析结构的难度。
最后,真核钠通道包含有比较多的柔性区域,还存在着多种多样的翻译后修饰,这都对其结构解析构成很大挑战。
因此,对于真核钠通道的结构生物学研究远远滞后于早在2003年即获得首个晶体结构的电压门控钾离子通道。包括欧美英日在内的全球数十个研究团队都在紧锣密鼓攻坚,力图获得首个真核钠通道的高分辨率结构。
突破点
在最新的《科学》论文中,颜宁研究组成功地克服了以上的层层瓶颈,获得了性质良好的蛋白样品,并利用单颗粒冷冻电镜的方法,重构出了可以清晰分辨绝大多数侧链的真核生物钠离子通道(命名为NavPaS)的三维结构。颜宁研究组利用电镜技术,但是反其道而行之,放弃了对于大分子量蛋白的追求,而利用序列分析选取长度最短的真核钠离子通道,成功利用重组技术获得了表达量较高、性质稳定均一的美洲蟑螂(电生理重要模式生物之一)的钠通道蛋白。该结构的解析为理解钠通道的离子选择性、电压依赖的激活与失活特性、配体抑制机理提供了重要的分子基础,为解释过去60多年的大量实验数据提供了结构模板,并为基于结构的分子配体开发奠定了基础。
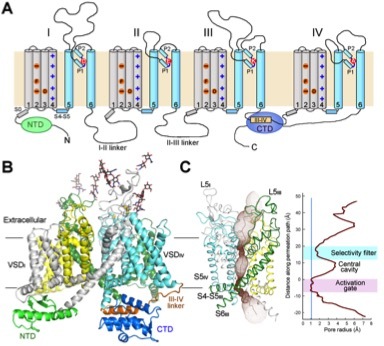 真核生物电压门控钠离子通道的拓扑图和三维电镜结构
真核生物电压门控钠离子通道的拓扑图和三维电镜结构
原文链接
http://science.sciencemag.org/content/early/2017/02/08/science.aal4326
NavRh相关文章链接
http://www.nature.com/nature/journal/v486/n7401/full/nature11054.html
Cav1.1相关文章链接
http://science.sciencemag.org/content/350/6267/aad2395.long
http://www.nature.com/nature/journal/v537/n7619/full/nature19321.html
RyR1相关文章链接
http://www.nature.com/nature/journal/v517/n7532/full/nature14063.html
http://www.nature.com/cr/journal/v26/n9/full/cr201689a.html
RyR2相关文章链接
http://science.sciencemag.org/content/354/6310/aah5324.full





