线粒体是细胞能量代谢中心。线粒体质量异常导致多种疾病,如神经退行性疾病,心血管疾病,糖尿病和肿瘤的发生。线粒体自噬是线粒体质量控制的重要机制之一,其分子调控机制目前是线粒体和细胞自噬研究领域的焦点科学问题。课题组前期研究发现了线粒体膜蛋白FUNDC1是线粒体自噬的特异受体,并深入分析了该受体调控线粒体自噬的分子机制。但线粒体自噬在生理和病理条件下如何发挥作用尚不清楚。为深入研究这一重要科学问题,该课题组制备了Fundc1组织特异敲除的小鼠。低氧(8%)处理野生型小鼠72 hours引起组织和器官中FUNDC1依赖的线粒体自噬。课题组进一步研究发现低氧诱导血小板线粒体自噬(图1),降低血小板活性。而人工合成的能干预FUNDC1介导的线粒体自噬的短肽(Peptide)能影响血小板线粒体质量和血小板活性。Fundc1基因敲除导致小鼠对低氧刺激和短肽(Peptide)不敏感。在缺血复灌(Ischemia/reperfusion,I/R)小鼠模型中也出现血小板线粒体自噬现象。而低氧预处理(Hypoxic preconditioning)可以显著降低I/R引起的心肌坏死面积,改善心脏功能。该研究揭示了一种新的低氧预处理(Hypoxic preconditioning)减少I/R损伤,改善心脏功能的新机制。这些研究为线粒体自噬和线粒体质量控制提供了新的认识,并为进一步阐明线粒体自噬在疾病发生中的作用提供了新的可能。该成果在预防和治疗心肌梗死及线粒体自噬生理病理功能调控方面具有重要的潜在医学价值。
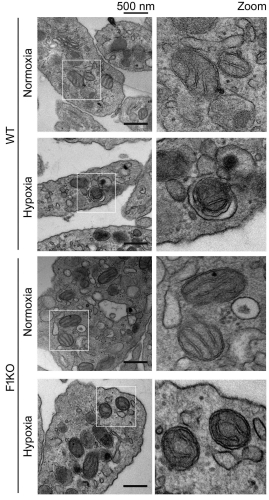
图1 低氧诱导血小板线粒体自噬





