2022年1月3日,高宁研究组在Cell Research上发表了题为 Structural insights into the membrane microdomain organization by SPFH family proteins 的研究论文,利用冷冻电镜技术研究了位于细菌内膜的由两种具有代表性的SPFH家族蛋白质分子(HflK、HflC)与AAA+蛋白酶FtsH形成的超级膜复合物的高分辨结构,揭示了SPFH家族蛋白质在细胞内不同的膜系统微域(microdomain)组织过程中的共性原理和分子基础。
细胞膜系统的组成、脂质和蛋白质的分布都具有高度异质性。原核生物和真核生物的细胞膜系统的一个共性就是它们都具有相对离散的功能特异化的微型区域(FMMs, functional membrane microdomains),但是这种微型膜域的分子组织基础一直未知。作为经典的细胞膜“镶嵌流动模型”的补充,上个世纪九十年代正式提出的“脂筏”模型是一种相对广泛接受的用来描述膜异质性的模型【1】,它指代的是在膜上形成的相对有序、离散性的、富含胆固醇、鞘脂和GPI-anchored蛋白质的微型区域。历史上,科学家对于FMM或者脂筏的认识和理解主要来源于两种实验手段:第一种是基于超速离心来分离“Detergent-resistant membranes (DRM)”,鉴定它们的脂质、蛋白质组成以及生物学功能;另一种是基于光学成像标记特定的脂质或者蛋白质分子,表征它们的物理尺寸(10-300 nm)、亚细胞分布及动力学性质。尽管在过去的二十多年内有几千篇关于脂筏的论文,但是由于细胞膜的高度动态性以及这些研究手段的非特异性,这一概念在细胞生物学领域仍然具有非常大的争议【2,3】。
SPFH(Stomatin、Prohibitin、Flotillin 和 HflK/C)家族是一类定位于各种各样生物膜系统的膜蛋白,包括质膜、核膜、高尔基体、内质网、内体、线粒体、叶绿体,乃至脂滴 (Browman et al., 2007)【4】。SPFH家族蛋白质是FMM中的标志性分子,基于其寡聚性质被推测在FMM的形成和组织过程中可能起到基础的支架作用。例如,早期的研究发现溶血性贫血病人的红细胞中缺失了Stomatin蛋白。Stomatin及其动物同源蛋白存在于质膜、细胞内的膜泡中,参与细胞内脂质运输以及机械感受型离子通道蛋白的调控等。在线虫和小鼠中,Stomatin的同源蛋白被发现参与到机械感知,可以调控酸通道和细胞骨架之间的信号传递【5,6】。Flotillin在细菌、动物、植物、真菌中广泛存在。在动物细胞中,Flotillin常与鞘磷脂和胆固醇一起形成脂筏结构,尤其是flotillin-1常被作为脂筏的标志性蛋白。Flotillin参与细胞内吞、以及膜上的多种信号转导过程【7】。Prohibitin(PHB)存在于所有的真核细胞,主要分布在线粒体内膜上,参与细胞内的多个生理过程,与衰老、细胞增殖、退行性疾病和代谢等疾病密切相关【8】。PHB(包括PHB1和PHB2)通过与线粒体内膜上的m-AAA蛋白酶形成超级复合物,参与线粒体内膜蛋白的质量监控。HflK和HflC是细菌中广泛存在的两种SPFH膜蛋白。它们是线粒体PHB的细菌同源蛋白,能够与锚定在细菌内膜的AAA+蛋白酶FtsH形成超大复合物(HflK-HflC-FtsH,简称为KCF复合物)从而调控膜蛋白的质量控制和稳态调控。
尽管SPFH家族数目众多并广泛存在于所有物种,参与了众多的基础生物学过程,但是SPFH家族蛋白质的寡聚组织形式、三维结构及其调控各异的膜相关分子过程的机制非常不清楚。本研究以KCF为SPFH家族的一个模式复合物,利用冷冻电镜三维重构技术研究了KCF复合物的组成形式和高分辨三维结构。
首先,冷冻电镜结构数据表明HflK/C以异源二聚体为基本单元,12个HflK分子和12个HflC分子间隔排列在内膜上形成跨膜的异二十四聚体的笼状结构。HflK/C的跨膜区域(N-terminal region)形成并隔离出大约直径20 nm的一个圆形膜区域;HflK/C的大部分氨基酸残基位于周质空间,并且组装成一个完全密封的笼状结构。更为有趣的是,FtsH六聚体可以悬挂到HflK/C形成的微型膜域中,一个笼状结构最多可以包含4个FtsH六聚体(图1)。FtsH六聚体的周质空间结构域(PD)完全包裹在HflK/C在周质空间形成的笼状结构中,与复合物中HflK分子的SPFH结构域直接相互作用。
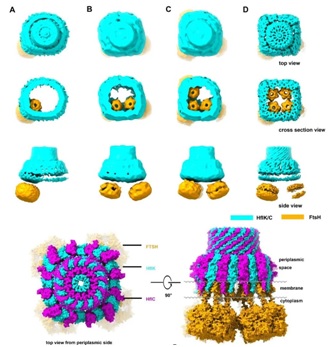
图1:KCF复合物(包含不同数目的FtsH六聚体)的结构全貌。
其次,基于对包含4个FtsH六聚体的KCF复合物的高分辨结构(3.3埃)的分析,论文发现了SPFH家族的一些之前未知的共有结构属性(图2):SPFH家族特有的SPFH区域可以被精确的划分为两个结构域(SPFH1和SPFH2),其中SPFH1结构域实际上是插膜结构域,大约近半的结构插入到细胞膜的外叶(outer leaflet)中;相邻的SPFH1结构域互相紧密作用,直接在外叶上划分了一个直径为20 nm的和周围脂质完全分开的微型区域。高分辨结构清晰的展示了HflK和HflC完整的从N-到C-端并排相互作用的寡聚形式:除了相互作用的SPFH1和SPFH2结构域,其中间的结构域(单根α螺旋,CC1和CC2)也互相紧密互作,通过右手螺旋形成笼状结构的壁;最靠近C末端的结构域包含有一个特征性的β-strand (β9),复合物中所有的HflK和HflC亚基各自贡献一条β-strand,从而形成一个稳定的β-barrel。
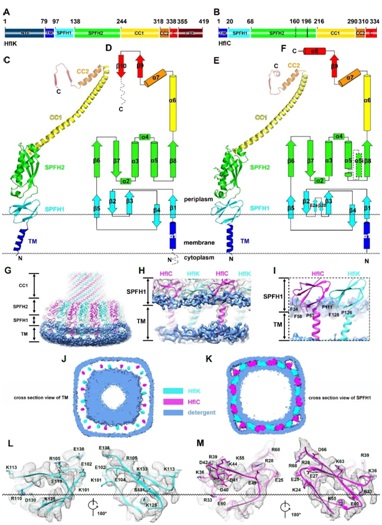
图2. HflK/C的结构模型、结构域组成及细胞膜微域的形成。
论文进一步确定了HflK亚基上参与识别和结合FtsH的氨基酸序列。基于这些结构信息以及生化实验数据,提出了HflK、HflC通过FtsH调控细菌膜蛋白稳态的分子机制:在正常生理状态下,HflK/C笼状结构能够将FtsH蛋白酶在空间上隔离,从而防止FtsH对细胞膜上功能性膜蛋白的降解,这对于维持位于异常拥挤的细胞膜上的膜蛋白稳定性至关重要;而对于非正常组装的膜蛋白,或者损伤的膜蛋白复合物,其游离末端的无序序列仍然能够被FtsH识别从而进行选择性降解(图3A-B)。
更为重要的是,论文对典型的SPFH家族蛋白质进行了基于序列的结构分析,发现所有的SPFH家族蛋白质的结构域组织都与HflK/C高度类似,由N端的SPFH1和SPFH2结构域,中间的CC结构域,以及C端的β片层结构域组成。这些分析表明所有的SPFH家族成员很有可能以一种相似的方式在不同亚细胞定位的细胞膜系统上形成笼状结构,从而形成不同尺寸的微型膜域。尤其值得指出的一点是,SPFH1作为插膜结构域,直接参与形成leaflet-specific的微型膜域,鉴于不同的SPFH蛋白质具有不同的膜拓扑学性质,SPFH具备调控不同leaflet的脂质流动性的能力(图3)。同时,HflK/C笼状结构招募和隔离FtsH六聚体的这一形式也为理解脂质微域的功能化提供了一个新颖的模型:不同的 SPFH蛋白质会通过与锚定在膜上的不同功能的膜蛋白(AAA+蛋白酶、离子通道、膜受体等)相互作用,横向隔离这些功能分子,从而赋予微型膜域的功能特异性(图3)。
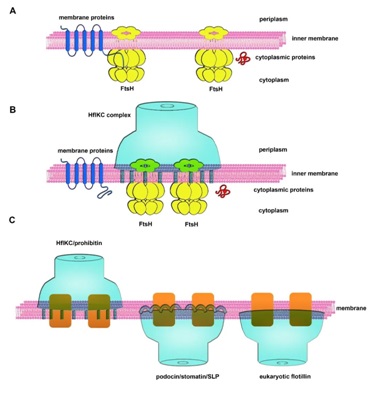
图3. KCF复合物的膜蛋白质量监控模型及SPFH家族蛋白在FMM组织中的结构基础。
综上所述,本研究通过细菌的SPFH家族的HflK、HflC的结构和功能解析阐明了一种非常新颖的膜蛋白复合物的组织形式,这对于理解其线粒体同源蛋白Prohibitins在人类相关的疾病中的分子机制非常关键。更为重要的是,这篇工作为理解FMM或者脂筏这一“模糊”的细胞生物学概念提供了具有“具象”的物理基础。SPFH蛋白质在膜上的笼状结构可以完美的解释现有“脂筏”模型中的一些重要的科学争议,必将会很大的促进这一领域的概念演化,也为整个SPFH家族蛋白质研究的研究提供了一个新起点。
Cell Research同期刊发了题为SPFH protein cage-one ring to rule them all 的Research Highlight。评论文章由德国Max Delbrück Center for Molecular Medicine的Oliver Daumke 和Gary R. Lewin撰写,指出了本论文对于理解功能性微型膜域的普适性分子组织原理的重要意义。
参考文献
1. Simons, K., and Ikonen, E. (1997). Functional rafts in cell membranes. Nature 387, 569-572.
2. Levental, I., Levental, K.R., and Heberle, F.A. (2020). Lipid Rafts: Controversies Resolved, Mysteries Remain. Trends Cell Biol 30, 341-353.
3. Sezgin, E., Levental, I., Mayor, S., and Eggeling, C. (2017). The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nat Rev Mol Cell Biol 18, 361-374.
4. Browman, D.T., Hoegg, M.B., and Robbins, S.M. (2007). The SPFH domain-containing proteins: more than lipid raft markers. Trends Cell Biol 17, 394-402.
5. Huang, M., Gu, G., Ferguson, E.L., and Chalfie, M. (1995). A stomatin-like protein necessary for mechanosensation in C. elegans. Nature 378, 292-295.
6. Wetzel, C., Hu, J., Riethmacher, D., Benckendorff, A., Harder, L., Eilers, A., Moshourab, R., Kozlenkov, A., Labuz, D., Caspani, O., et al. (2007). A stomatin-domain protein essential for touch sensation in the mouse. Nature 445, 206-209.
7. Glebov, O.O., Bright, N.A., and Nichols, B.J. (2006). Flotillin-1 defines a clathrin-independent endocytic pathway in mammalian cells. Nat Cell Biol 8, 46-54.
8. Artal-Sanz, M., and Tavernarakis, N. (2009). Prohibitin and mitochondrial biology. Trends Endocrinol Metab 20, 394-401.





